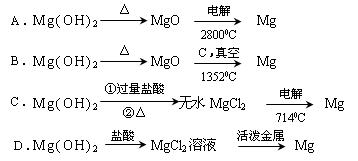
题目内容
从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(1)海水淡化的方法主要有
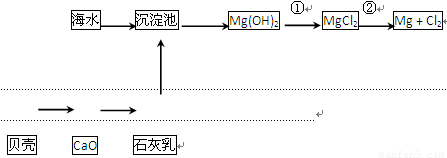
(2)从海水中提取镁的流程如下图所示: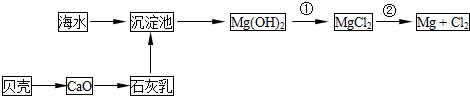
反应①的离子方程式为
反应②的化学方程式为
(3)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为
(1)海水淡化的方法主要有
海水冻结法、蒸馏法、电渗析法、离子交换法(任选一答)
海水冻结法、蒸馏法、电渗析法、离子交换法(任选一答)
(填一种);(2)从海水中提取镁的流程如下图所示:

反应①的离子方程式为
Mg(OH)2+2H+═Mg2++2H2O
Mg(OH)2+2H+═Mg2++2H2O
;反应②的化学方程式为
MgCl2(熔融)
Mg+Cl2↑;
| ||
MgCl2(熔融)
Mg+Cl2↑;
;
| ||
(3)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为
2Br-+Cl2═Br2+2Cl
2Br-+Cl2═Br2+2Cl
.分析:(1)根据海水淡化的常用方法:有海水冻结法、电渗析法、蒸馏法、离子交换法;
(2)根据对应步骤写出对应的化学方程式或离子方程式;
(3)根据氯气能氧化溴离子得到氯离子和单质溴;
(2)根据对应步骤写出对应的化学方程式或离子方程式;
(3)根据氯气能氧化溴离子得到氯离子和单质溴;
解答:解:(1)因海水淡化的常用方法:有海水冻结法、电渗析法、蒸馏法、离子交换法等,故答案为:海水冻结法、蒸馏法、电渗析法、离子交换法(任选一答);
(2)因反应①是Mg(OH)2与盐酸反应:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式:Mg(OH)2+2H+═Mg2++2H2O;反应②是电解熔融MgCl2:MgCl2(熔融)
Mg+Cl2↑;
故答案为:Mg(OH)2+2H+═Mg2++2H2O MgCl2(熔融)
Mg+Cl2↑;
(3)因氯气能氧化溴离子得到氯离子和单质溴:2Br-+Cl2═Br2+2Cl-;
故答案为:2Br-+Cl2═Br2+2Cl-
(2)因反应①是Mg(OH)2与盐酸反应:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式:Mg(OH)2+2H+═Mg2++2H2O;反应②是电解熔融MgCl2:MgCl2(熔融)
| ||
故答案为:Mg(OH)2+2H+═Mg2++2H2O MgCl2(熔融)
| ||
(3)因氯气能氧化溴离子得到氯离子和单质溴:2Br-+Cl2═Br2+2Cl-;
故答案为:2Br-+Cl2═Br2+2Cl-
点评:电解法制备镁要用无水MgCl2,不能用MgCl2?6H2O,否则得不到镁.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
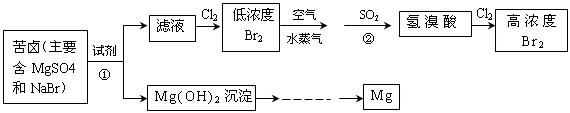
 时第一次通入Cl
时第一次通入Cl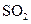 表现 (填“氧化”或“还原”)性;
表现 (填“氧化”或“还原”)性;