题目内容
14.向含amolAlCl3的溶液中加入含b molNaOH的溶液:(1)当b≤3a时,反应的离子方程式为Al3++3OH-═Al(OH)3↓,生成Al(OH)3沉淀amol.
(2)当b≥4a时,反应的离子方程式为Al3++4OH-═AlO2-+2H2O,生成Al(OH)3沉淀0mol.
(3)当3a<b<4a时,生成Al(OH)3沉淀4a-bmol.
分析 根据反应AlCl3+3NaOH═Al(OH)3↓+3KCl、Al(OH)3+NaOH═NaAlO2+2H2O,并利用a、b的大小来分析.
解答 解:(1)若a:b=1:3,即b=3a时,发生AlCl3+3KOH═Al(OH)3↓+3KCl,即Al3++3OH-═Al(OH)3↓,生成沉淀的物质的量等于AlCl3的物质的量,即为amol,b≤3a时,也是此情况,故答案为:Al3++3OH-═Al(OH)3↓;a;
(2)若b≥4a,发生Al3++4OH-═AlO2-+2H2O,则生成沉淀的物质的量为0,故答案为:Al3++4OH-═AlO2-+2H2O;0;
(3)若3:1<b:a<4:1时即3a<b<4a时,发生Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,生成沉淀的物质的量等于amol-(b-3a)mol=(4a-b)mol,故答案为:4a-b.
点评 本题考查氯化铝与碱的反应,明确碱的量的多少发生的对应的化学反应是解答本题的关键,注意利用极限和区间的方法来分析生成沉淀的几种可能性.

练习册系列答案
相关题目
4.下列各组离子在溶液中可大量共存的是( )
| A. | K+,Cl-,CO32-,Na+ | B. | H+,Ba2+,Fe3+,S2- | ||
| C. | NH4+,SO42-,K+,OH- | D. | H+,NO3-,Na+,SiO32- |
2.某物质A加热时按下式分解:2A═2B+C+3D (产物均为气体),现测得由生成物组成的混合物气体对H2的相对密度为22.86.则反应物A的摩尔质量为( )
| A. | 22.86g•mol-1 | B. | 45.72g•mol-1 | C. | 80.01g•mol-1 | D. | 137.2g•mol-1 |
19.下列反应中二氧化硫被氧化的是( )
| A. | SO2+2H2S═3S+2H2O | B. | SO2+2NaOH═Na2SO3+H2O | ||
| C. | SO2+H2O═H2SO3 | D. | SO2+Cl2+2H2O═4H++2Cl-+SO42- |
 X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两个未成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物.W与Q同主族,元素N的第三能层共有5对成对电子.请回答下列问题:
X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两个未成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物.W与Q同主族,元素N的第三能层共有5对成对电子.请回答下列问题: ;
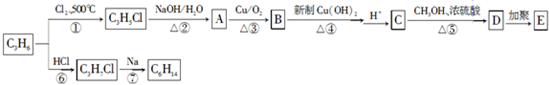
;
 .
. +6NaBr.
+6NaBr.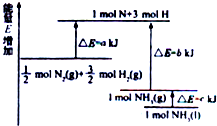 氮及其化合物与科技、生活等密切相关.
氮及其化合物与科技、生活等密切相关.