题目内容
50mL18mol/L的H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为
A.大于0.90mol B.小于0.45mol
C.等于0.45mol D.在0.45mol和0.90mol之间
【答案】
B
【解析】
试题分析:浓硫酸是氧化性酸,开始阶段铜和浓硫酸反应生成SO2,但随着反应的进行,硫酸的浓度逐渐降低,稀硫酸与铜不反应。根据反应式Cu+2H2SO4(浓)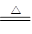 CuSO4+2H2O+SO2↑可知,实际被还原的H2SO4的物质的量小于0.45mol,答案选B。
CuSO4+2H2O+SO2↑可知,实际被还原的H2SO4的物质的量小于0.45mol,答案选B。
考点:考查铜与浓硫酸反应的有关判断和计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,贴近高考。该题的关键是明确稀硫酸与浓硫酸的性质差异,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用知识解决实际问题的能力。

练习册系列答案
相关题目
对下列事实的解释正确的是( )
| A、氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 | B、用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 | C、向50mL18mol?L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol | D、常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应 |
对下列事实的解释错误的是( )
| A、在蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有脱水性 | B、向50mL18mol?L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量小于0.45mol | C、常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 | D、反应CuSO4+H2S═CuS+H2SO4能进行,说明CuS既不溶于水也不溶于稀H2SO4 |
对下列事实的解释不正确的是( )
| A、在蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有脱水性 | B、常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 | C、向50mL18mol?L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量小于0.45mol | D、实验室用MnO2和浓盐酸反应制取Cl2中含有少量的HCl气体杂质,可通过饱和的食盐水除去 |