题目内容
【题目】硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应。硼与氯气反应生成三氯化硼(BCl3),生成的三氯化硼遇水水解产生白雾(已知:BCl3的熔点为-107.3℃,沸点为12.5℃ ),且三氯化硼用于制取乙硼烷(B2H6)。某兴趣小组设计如图所示装置制备三氯化硼。

回答下列问题:
(1)装置A中发生反应的离子方程式为_____________________________。
(2)装置B中的作用是________________,装置E的作用是______________________。
(3)装置D中发生反应的化学方程式为______________________________________。
(4)装置F的作用是________________,可以用一个盛装________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中的HCl 冷却和收集三氯化硼 2B+3Cl2
Mn2++Cl2↑+2H2O 除去氯气中的HCl 冷却和收集三氯化硼 2B+3Cl2![]() 2BCl3 防止水蒸气进入装置E 碱石灰
2BCl3 防止水蒸气进入装置E 碱石灰
【解析】
实验目的是制备BCl3,实验原理是2B+3Cl2 ![]() 2BCl3,A装置制备Cl2,B装置除去HCl,C装置干燥氯气,D装置制备BCl3,E装置收集BCl3,F装置防止G中水蒸气进入E中U型管,G装置吸收多余Cl2;
2BCl3,A装置制备Cl2,B装置除去HCl,C装置干燥氯气,D装置制备BCl3,E装置收集BCl3,F装置防止G中水蒸气进入E中U型管,G装置吸收多余Cl2;
(1)A为制备Cl2的装置,其离子反应方程式为MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
(2)A中制取的氯气中混有水蒸气和HCl,因此装置B的目的是除去HCl;装置E的目的是冷却和收集BCl3;
(3)D装置是制备BCl3,其反应方程式为:2B+3Cl2 ![]() 2BCl3;
2BCl3;
(4)BCl3遇水水解,F装置中浓硫酸的作用是防止G中水蒸气进入装置E;根据F装置和G装置的作用,可以用盛有碱石灰的干燥管代替F和G。

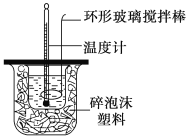
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。