题目内容
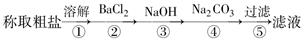
Ⅰ.在实验室制备少量纯净的KCl。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。

(1)过滤时需要用到的玻璃仪器有 。
。
(2)检验加入BaCl2溶液后SO42-是否沉淀完全的操作为 。
(3)若用硝酸钡来代替氯化钡,请判断是否可行, ,理由是
(4)某同学认为该实验方案中加适量BaCl2溶液不容易控制,应加入过量BaCl2溶液。实验操作方案如下:

沉淀A的化学式是 ,溶液③中的溶质的化学式是 。
Ⅱ.工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
(1)提出合理假设。
假设1:该漂白粉未变质,含有CaCl2,并含 ;
假设2:该漂白粉全部变质,含有CaCl2,并含 ;
假设3:该漂白粉部分变质,含有Ca Cl2,又含有Ca(ClO)2、CaCO3。
Cl2,又含有Ca(ClO)2、CaCO3。
(2)设计实验方案,进行实验。请在答题卡上写出实验步骤、预期实验现象和实验结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)

(1)过滤时需要用到的玻璃仪器有
 。
。(2)检验加入BaCl2溶液后SO42-是否沉淀完全的操作为 。
(3)若用硝酸钡来代替氯化钡,请判断是否可行, ,理由是
(4)某同学认为该实验方案中加适量BaCl2溶液不容易控制,应加入过量BaCl2溶液。实验操作方案如下:

沉淀A的化学式是 ,溶液③中的溶质的化学式是 。
Ⅱ.工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
(1)提出合理假设。
假设1:该漂白粉未变质,含有CaCl2,并含 ;
假设2:该漂白粉全部变质,含有CaCl2,并含 ;
假设3:该漂白粉部分变质,含有Ca
 Cl2,又含有Ca(ClO)2、CaCO3。
Cl2,又含有Ca(ClO)2、CaCO3。(2)设计实验方案,进行实验。请在答题卡上写出实验步骤、预期实验现象和实验结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
| 实验步骤 | 预期现象和结论 | |
| ① | 取少量上述漂白粉于试管中, | |
| ② | | |
| ③ | | |
Ⅰ.(1)漏斗、玻璃棒、烧杯(3分,各1分)
(2)静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全(2分, “少量上层清液”、“BaCl2溶液”、现象和结论三个要点)
(3)不可行,会引入NO3- (2分,各1分)
(4)BaCO3(1分); HCl(1分)
Ⅱ.(1)假设1.含有Ca(ClO)2(1分),
假设2.含有CaCO3(1分)
(2)(4分)
(2)静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全(2分, “少量上层清液”、“BaCl2溶液”、现象和结论三个要点)
(3)不可行,会引入NO3- (2分,各1分)
(4)BaCO3(1分); HCl(1分)
Ⅱ.(1)假设1.含有Ca(ClO)2(1分),
假设2.含有CaCO3(1分)
(2)(4分)
| 实验步骤 | 预期现象和结论 | |
| ① | 加入适量1mol/L盐酸溶解后,再将产生的气体导入到澄清石灰水中(1分) | (1)若澄清石灰水未见浑浊,则固体中不含CaCO3; (2)若澄清石灰水变浑浊,则固体中含有 CaCO3(1分) |
| ② | 向步骤①反应后的试管滴入1~2滴品红溶液,振荡(1分)(或另外取 样操作) 样操作) | (1)若品红褪色,固体中存在 Ca(ClO)2; (2)若品红不褪色,则固体中不存在 Ca  (ClO)2(1分) (ClO)2(1分) |
| ③ | | |
略

练习册系列答案
相关题目

 生成,可向溶液中滴加Ba(NO3)2溶液
生成,可向溶液中滴加Ba(NO3)2溶液