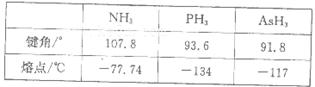
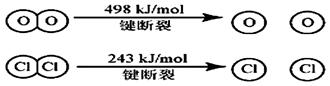
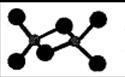
题目内容
二氧化碳和纳在一定条件下可制得金刚石,其化学方程式为3CO2+4Na=2X+C(金刚石)。设NA为阿伏加德罗常数的值,下列有关此反应的叙述中,不正确的是
| A.1molC(金刚石)中含有C—C键数目为2NA |
| B.当有0.4molNa参与反应时,被还原的CO2为0.3NA |
| C.金刚石与石墨互为同素异形体 |
| D.X的化学式为Na2CO3 |
B
试题分析:A、金刚石中每个C原子形成4个C-C,每个C-C键含有1对共用电子对。碳原子的价电子是4个,所以平均每个碳原子形成4÷2=2个C-C键,因此1mol金刚石中含有C-C键为2mol,故含有C-C数目为2mol×NAmol-1=2NA,故A正确;B、根据由原子守恒可知,X为Na2CO3。在反应中碳原子的化合价从+4价降低到0价,得到4个电子。钠元素的化合价从0价升高到+1价,失去1个电子。所以根据电子得失守恒可知,当有0.4molNa参与反应时,故被还原的二氧化碳为0.4mol÷4=0.1mol,其个数是0.1mol×NAmol-1=0.1NA,故B错误;C、金刚石与石墨都是碳元素组成的结构不同的单质,互为同素异形体,故C正确;D、反应前有3个C原子,6个O原子,4个Na原子,反应后除2X外,还有1个C原子,因此根据原子守恒可推断出2X由4个Na原子,2个C原子,6个O原子组成,则1个X组成为:2个Na原子,1个C原子,3个O原子,由此可推断出X的化学式为:Na2CO3,故D正确,答案选B。

练习册系列答案
相关题目
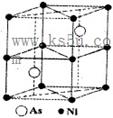
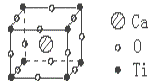
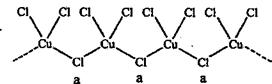
 关系如下图所示),经测定其密度为
关系如下图所示),经测定其密度为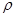 g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )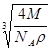 cm
cm