题目内容
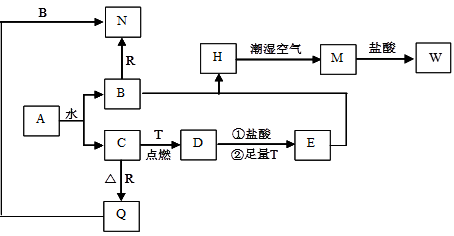
(14分)利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有 。
(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示) 。
在实验室中,常将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示)。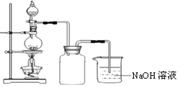
(3)写出烧瓶中发生反应的离子方程式为
(4)广口瓶的作用是
(5)为符合绿色化学的要求,某研究性学习小组进行如下
设计:将3.2 g铜丝放到45 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入18 mL 10%的H2O2,反应0.5h后,升温到60 ℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5 g。请回答:
①加热时温度不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
⑴ Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑;
⑵ 2Cu+O2+2H2SO4=2CuSO4+2H2O 或2Cu+O2=2CuO,CuO+H2SO4=CuSO4+H2O ;
⑶ 3Cu+8H++3NO3- =3Cu2++2NO↑+4H2O ;
⑷ 安全瓶 ;⑸ ①防止双氧水分解 ;②84% 。
解析试题分析:(1)铁丝表面有铁锈。投入稀H2SO4中发生反应的两种方程式为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑;(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是使Cu变为氧化铜,与酸反应得到CuSO4.反应的方程式为:2Cu+O2+2H2SO4=2CuSO4+2H2O 或2Cu+O2=2CuO,CuO+H2SO4=CuSO4+H2O ;(3)在烧瓶中Cu与稀硝酸发生反应的离子方程式为:3Cu+8H++3NO3- =3Cu2++2NO↑+4H2O ;(4)广口瓶的作用是安全瓶,防止倒吸现象的发生;(5)①加热时温度不宜过高是由于在反应的过程中使用了H2O2,而H2O2受热容易分解,使用温度不宜过高。②n(Cu)=" 3.2" g÷64g/mol=0.05mol,n(H2SO4)=" 0.045" L×1.5 mol/L=" 0.0675" mol硫酸过量,所以产生的CuSO4按照Cu来计算,理论产量:0.05mol×250g/mol=12.5g。因此CuSO4·5H2O的产率为(10.5 g÷12.5g)×100%=84%。
考点:考查物质的制取方法、化学方程式、离子方程式的书写、反应条件的选择及物质的产率的计算。

将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
| A.镁铝合金与盐酸反应转移电子总数为0.lNA | B.x=2y |
| C.沉淀是Mg(OH)2和Al(OH)3的混合物 | D.2x=y |
(16分)某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色。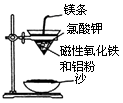
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的
磁性氧化铁外,还有一种可能原因是 。
② 若要证明反应所得“铁块”中含有金属铝,可用 (填化学式)溶液,所发生反应的离子方程式为 。
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H+ + 4I-+ O2 = 2I2 + 2H2O。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8 mol·L-1 KI溶液、0.1 mol·L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A—C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 / mL | 出现蓝色时间 /s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | | | | | | t |
②A—C三组实验时,都加入了5mL水,其目的是 。
③B组实验中“没出现蓝色”,原因是 。
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标。
⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结
论 。
(本题共13分)甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,请用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,其中Fe3+ →Fe2+ ;请写出Fe3+ 跟SO32-反应的离子方程式
______________。
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 请用离子方程式和必要的文字说明步骤Ⅲ中出现红褐色的原因 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。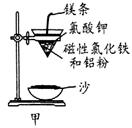


(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。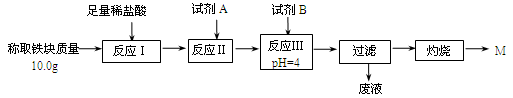
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。

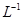 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: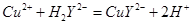 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。