题目内容
酸雨是煤和石油燃烧时生成的硫及氮的氧化物溶于水生成硫酸和硝酸之缘故.现取某酸雨试样分析得如下数据:
|
分析:根据溶液呈电中性,溶液中阴阳离子所带电荷相等计算氢离子浓度.
解答:解:溶液呈电中性,溶液中阴阳离子所带电荷相等,所以c(Na+)+c(NH4+)+c(H+)=c(Cl-)+c(NO3-)+2c(SO42- ),
所以2.0×10-5+1.9×10-5+c(H+)=6.0×10-5+2.4×10-5+2×2.8×10-5,c(H+)=1.01×10-4mol/L,
故选C.
所以2.0×10-5+1.9×10-5+c(H+)=6.0×10-5+2.4×10-5+2×2.8×10-5,c(H+)=1.01×10-4mol/L,
故选C.
点评:本题考查离子浓度的计算,明确溶液呈电中性是解本题关键,注意计算硫酸根离子电荷时要用浓度乘以2,为易错点.

练习册系列答案
相关题目
酸雨是煤和石油燃烧时生成的硫及氮的氧化物溶于水生成硫酸和硝酸之缘故。现取某酸雨试样分析得如下数据:
组分 | 浓度(mol·L-1) | 组分 | 浓度(mol·L-1) |
| 1.9×10-5 | Na+ | 2.0×10-5 |
| 2.4×10-5 | Cl- | 6.0×10-5 |
| 2.8×10-5 |
|
|
则此酸雨中H+的物质的量浓度(mol·L-1)最接近的数值是( )
酸雨是煤和石油燃烧时生成的硫及氮的氧化物溶于水生成硫酸和硝酸之缘故.现取某酸雨试样分析得如下数据:
则此酸雨中H+的物质的量浓度最接近的数值是( )
A.1.01×10-6
B.1.01×10-5
C.1.01×10-4
D.1.01×10-3
| 组分 | 浓度/mol?L-1 | 组分 | 浓度/mol?L-1 |
NH | 1.9×10-5 | Na+ | 2.0×10-5 |
NO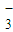 | 2.4×10-5 | Cl- | 6.0×10-5 |
SO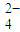 | 2.8×10-5 |
A.1.01×10-6
B.1.01×10-5
C.1.01×10-4
D.1.01×10-3
酸雨是煤和石油燃烧时生成的硫及氮的氧化物溶于水生成硫酸和硝酸之缘故。现取某酸雨试样分析得如下数据:
| 组分 | 浓度/mol·L-1 | 组分 | 浓度/mol·L-1 |
| NH | 1.9×10-5 | Na+ | 2.0×10-5 |
| NO | 2.4×10-5 | Cl- | 6.0×10-5 |
| SO | 2.8×10-5 |
则此酸雨中H+的物质的量浓度(mol·L-1)最接近的数值是
A.1.01×10-6 B.1.01×10-5 C.1.01×10-4 D.1.01×10-3