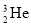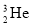题目内容
(1)某建筑材料,主要成分为铝硅酸盐,化学式是MgAl2H4Si4O14;化学式改写成氧化物形式为_________。该材料与酸或碱反应时可以看作各氧化物分别与酸、碱反应,则材料该与足量的氢氧化钠反应后过滤,滤渣主要是_______。
(2)除去FeCl2溶液中少量的FeCl3最好加入_________物质。
(3)鉴别Na2CO3和NaHCO3溶液可选用_________。(填序号)
①NaOH;②Ca(OH)2;③BaCl2;④K2SO4;⑤Ca(NO3)2
(4)某溶液中有①SO42―②Mg2+③Fe2+④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,加热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
(5)将盛有18mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是( )
①1.2mL②2.4mL③3.6mL④5.2mL
A.①②B.①③C.②④D.①④
(1) MgO·Al2O3·4SiO2·2H2O MgO(各1分)
(2)Fe (3)③ ⑤ (4)Fe2+ (5)C
【解析】
试题分析:(1) 硅酸盐由于组成比较复杂,常用氧化物的形式表示:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。氧化物的顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个守恒原则配置系数。MgO、Al2O3均能和足量的稀硝酸反应,生成溶液,只有SiO2和硝酸不反应,过滤后成为滤渣,故答案为:SiO2;
(2)因为铁离子能和铁反应生成亚铁离子,化学方程式为2FeCl3+Fe═3FeCl2,故可用铁除去FeCl2溶液中的少量氯化铁;
(3)①NaOH与Na2CO3不反应,能和NaHCO3反应,但是没有明显现象,所以无法用NaOH鉴别:
②Na2CO3与NaHCO3都与石灰水反应,虽然反应的离子方程式不同,但都能生成CaCO3沉淀,故不能用石灰水鉴别它们;
③BaCl2溶液滴加到Na2CO3溶液中能产生白色沉淀;滴加到NaHCO3溶液中无白色沉淀产生,所以可以鉴别;
④K2SO4与Na2CO3,K2SO4与NaHCO3都不反应,所以无法用K2SO4鉴别;
⑤Ca(NO3)2与BaCl2溶液类似,Ca(NO3)2溶液滴加到Na2CO3溶液中能产生白色沉淀;滴加到Ca(NO3)2溶液中无白色沉淀产生,所以可以鉴别;
(4)混合溶液中加入过量的NaOH时,生成Mg(OH)2、Fe(OH)2沉淀和NaAlO2,Fe(OH)2沉淀在空气中不稳定,迅速氧化生成Fe(OH)3,再向混合物中加入过量盐酸,则Mg(OH)2、Fe(OH)3和NaAlO2与过量酸作用分别生成MgCl2、AlCl3、FeCl3,则减少的离子主要是Fe2+,
(5)氧气过量,则剩余2mL无色气体为氧气,设参加反应的氧气的体积为x,则有:
4NO2+O2+2H2O=4HNO3
4x x
4x+x=18mL-2mL=16mL,
x=3.2mL,所以氧气的体积为:3.2mL+2mL=5.2mL;
如NO2过量,则剩余2mL无色气体为NO,设氧气的体积为y,
4NO2+O2+2H2O=4HNO3
4y y
3NO2+H2O=2HNO3+NO
3 1
(18mL-y-4y) 2
y=2.4mL,
考点:考查元素及其化合物的性质。

 备战中考寒假系列答案
备战中考寒假系列答案