题目内容
下列分子中的中心原子杂化轨道的类型相同的是( )
| A.CO2与H2O | B.CH4与NH3 | C.BeCl2与BF3 | D.C2H2与C2H4 |
B
解析试题分析:A.在CO2中C原子的杂化方式为sp,而H2O 中O原子的杂化方式为sp3,二者中心原子杂化轨道的类型不相同。错误。B.CH4中C原子与NH3中的N的杂化方式为sp3,二者中心原子杂化轨道的类型相同。正确。C.BeCl2中的Be原子的杂化方式为sp, BF3中的Be原子的杂化方式为sp2.二者中心原子杂化轨道的类型不相同。错误。D.C2H2中的C原子的杂化方式为sp, C2H4中的C原子的杂化方式为sp2, 二者中心原子杂化轨道的类型不相同。错误。
考点:考查分子中的中心原子杂化轨道的类型的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
表中原子化热、晶格能、键能的单位都是kJ·mol-1
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H= - 602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法正确的是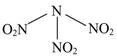
| A.分子中N、O间形成的共价键是非极性键 | B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 | D.15.2 g该物质含有6.02×1022个原子 |
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,BeCl2属于( )
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由非极性键构成的非极性分子 |
下列电子式中,正确的是
A. | B. | C. | D. |
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。下列关于天然气水合物中两种分子极性的描述正确的是 。
| A.两种都是极性分子 |
| B.两种都是非极性分子 |
| C.CH4是极性分子,H2O是非极性分子 |
| D.H2O是极性分子,CH4是非极性分子 |
下列物质中,含有非极性共价键的是( )
| A.N2 | B.CO2 | C.NaOH | D.CH4 |
下列各物质中,化学键类型完全相同的是
| A.Na2O2和NaOH | B.CH3COONa和NaOH |
| C.CCl4和H2O | D.CO2和H2O2 |
下列物质中,既含有离子键又含有极性共价键的是( )
| A.Na2O2 | B.MgCl2 | C.HCl | D.NH4Cl |