题目内容
【题目】现有一份含有FeCl3和FeCl2固体的混合物,为测定FeCl2的含量,进行如下实验:
①称取混合物样品的质量7.06g,将样品溶解
②向溶解后的溶液中,加入足量的双氧水
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4.00g
根据实验回答下列问题:
(1)样品溶解过程中需加入 ,以防止 ;
(2)写出溶解后的溶液与双氧水反应的离子方程式 ;
(3)过滤操作中除用漏斗外,还需要的玻璃仪器有 ;
(4)简述检验实验步骤④中沉淀已经洗涤干净的方法 ;
(5)通过实验所得数据,计算固体样品中FeCl2的质量分数: ;
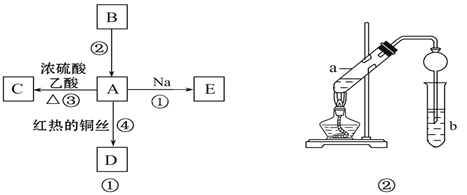
(6)实验室采用如图装置制取少量无水FeCl3固体.(已知FeCl3固体易潮解,部分夹持仪器已略去.)
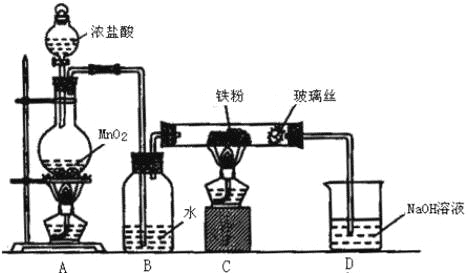
该装置存在明显缺陷,得不到无水FeCl3固体,请你对该装置进行合理的改进: .
【答案】(1)稀盐酸;FeCl3和 FeCl2水解而使溶液浑浊;
(2)2Fe2++2H++H2O2=2Fe3++2H2O;
(3)玻璃棒、烧杯;
(4)取最后的洗涤液少量,滴加硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净;
(5)53.97%;
(6)在 B、C 之间和C、D之间分别增加盛有浓硫酸的洗气瓶,防止 FeCl3吸水而潮解.
【解析】试题分析:现有一份含有FeCl3和FeCl2固体的混合物,为测定FeCl2的含量,
①称取混合物样品的质量7.06g,将样品溶解,溶解过程中需要加入稀盐酸抑制氯化铁、氯化亚铁水解,避免生成沉淀;
②向溶解后的溶液中,加入足量的双氧水,是氧化亚铁离子为铁离子,
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀氢氧化铁,
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4.00g为氧化铁,结合铁元素守恒和质量关系列式计算得到氯化亚铁质量,计算得到氯化亚铁含量;
(1)样品溶解过程中需加入稀盐酸,主要是抑制氯化铁、氯化亚铁水解;
(2)酸性溶液中过氧化氢氧化亚铁离子为铁离子;
(3)过滤操作过程、装置选择所需玻璃仪器;
(4)简述检验实验步骤④中沉淀已经洗涤干净的方法是滴加硝酸酸化的硝酸银溶液检验洗涤液中是否含氯离子;
(5)设原FeCl3和FeCl2固体的混合物中氯化亚铁物质的量为x,氯化铁物质的量为y,
127x+162.5y=7.06
x+y=![]() ×2
×2
计算得到氯化亚铁质量分数;
(6)氯化铁易吸收水蒸气,通过装置B中水吸收氯化氢,得到氯气中混有水蒸气,进入装置C,会使生成的氯化铁潮解,氢氧化钠溶液中水蒸气也会进入装置C影响产物的纯度.
解:现有一份含有FeCl3和FeCl2固体的混合物,为测定FeCl2的含量,
①称取混合物样品的质量7.06g,将样品溶解,溶解过程中需要加入稀盐酸抑制氯化铁、氯化亚铁水解,避免生成沉淀;
②向溶解后的溶液中,加入足量的双氧水,是氧化亚铁离子为铁离子,
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀氢氧化铁,
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4.00g为氧化铁,结合铁元素守恒和质量关系列式计算得到氯化亚铁质量,计算得到氯化亚铁含量.
(1)上述分析可知样品溶解过程中需加入稀盐酸,主要是抑制氯化铁、氯化亚铁水解,防止溶解过程中生成沉淀使溶液变浑浊,
故答案为:稀盐酸;FeCl3和 FeCl2水解而使溶液浑浊;
(2)酸性溶液中过氧化氢氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)过滤操作过程、装置选择所需玻璃仪器为漏斗、玻璃棒、烧杯,过滤操作中除用漏斗外,还需要的玻璃仪器有玻璃棒、烧杯,
故答案为:玻璃棒、烧杯;
(4)检验实验步骤④中沉淀已经洗涤干净的方法是滴加硝酸酸化的硝酸银溶液检验洗涤液中是否含氯离子,具体步骤为:取最后的洗涤液少量,滴加硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净,
故答案为:取最后的洗涤液少量,滴加硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净;
(5)设原FeCl3和FeCl2固体的混合物中氯化亚铁物质的量为x,氯化铁物质的量为y,
127x+162.5y=7.06
x+y=![]() ×2
×2
x=0.03mol
y=0.02mol
计算得到氯化亚铁质量分数=![]() ×100%=53.97%,
×100%=53.97%,
故答案为:53.97%;
(6)装置A是制备氯气装置,生成的氯气中含水蒸气、氯化氢,通过装置B中水吸收氯化氢,得到氯气中混有水蒸气,进入装置C,会使生成的氯化铁潮解,剩余氯气被氢氧化钠溶液吸收,防止污染空气,装置BC和装置CD间都会导致水蒸气进入装置C,氯化铁易吸收水蒸气发生潮解,所以在 B、C 之间和C、D之间分别增加盛有浓硫酸的洗气瓶,防止 FeCl3吸水而潮解,
故答案为:在 B、C 之间和C、D之间分别增加盛有浓硫酸的洗气瓶,防止 FeCl3吸水而潮解.