题目内容
【题目】SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理SO2的烟气,流程如下:
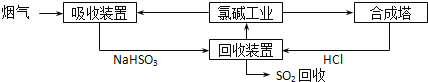
①“吸收装置”中发生反应的离子方程式_____________________。
②合成塔中每合成1mol气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式_____________。
③上述流程中循环利用的物质是____________________。
(2)方法二:利用FeCl3溶液氧化吸收烟气中SO2
①该反应的离子方程式________________________(反应a)。为验证该反应,同学们将SO2通入0.05mol/LFeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。关于红褐色液体,以下是同学们的分析推测与实验。
分析推测 | 实验步骤及现象 |
甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 | I、制备Fe(OH)3胶体并检验 II、分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
②利用胶体的_________________(填性质)可以检验步骤I中是否得到了Fe(OH)3胶体。
③根据反应b说明步骤II中液体颜色变化的原因是______________________(用离子方程式及必要的文字说明)。
【答案】(1)①SO2+OH-=HSO3-;
②H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ·mol-1;
③NaCl溶液。
(2)①2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;②丁达尔效应
③加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动
【解析】
试题分析:(1)①分析流程和信息知吸收装置中SO2和氯碱工业产品之一NaOH溶液反应生成亚硫酸氢钠,离子方程式为SO2+OH-=HSO3-;②已知每合成1mol HCl放出热量92.3kJ,其热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ·mol-1;③回收装置中NaHSO3溶液与HCl反应生成NaCl溶液,NaCl溶液又是氯碱工业的原料,故循环利用的物质是NaCl溶液。
(2)①利用FeCl3溶液的氧化性吸收烟气中的SO2,SO2在溶液中被氧化为SO42-,同时Fe3+被还原为Fe2+,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;②丁达尔效应是检验胶体的常用方法;③Fe3+能被铁粉还原为Fe2+,2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动。