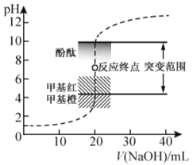
题目内容
【题目】ClO2是一种优良的消毒剂,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,实验室在50℃时制备ClO2。
实验Ⅰ:制取并收集ClO2,装置如图所示:
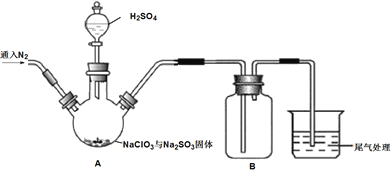
(1)写出用上述装置制取ClO2的化学反应方程式_____________。
(2)装置A中持续通入N2的目的是___________。装置B应添加__________(填“冰水浴”、“沸水浴”或“50℃的热水浴”)装置。
实验Ⅱ:测定装置A中ClO2的质量,设计装置如图:
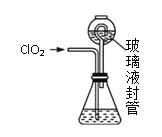
过程如下:
①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
②按照右图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口;
③将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
④用c mol·L1 Na2S2O3标准液滴定锥形瓶中的液体,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I+S4O62-)。
(3)装置中玻璃液封管的作用是_____________。
(4)滴定终点的现象是___________________。
(5)测得通入ClO2的质量m(ClO2)=_______g(用整理过的含c、V的代数式表示)。
【答案】![]() 降低ClO2的浓度,防止ClO2的浓度过高而发生分解,引起爆炸 冰水浴 防止ClO2逸出,使ClO2全部反应,准确测定ClO2的质量 溶液由蓝色变为无色,并且在30s内颜色不发生变化 1.35×10-2cV
降低ClO2的浓度,防止ClO2的浓度过高而发生分解,引起爆炸 冰水浴 防止ClO2逸出,使ClO2全部反应,准确测定ClO2的质量 溶液由蓝色变为无色,并且在30s内颜色不发生变化 1.35×10-2cV
【解析】
Ⅰ.(1)根据题给信息可知:NaClO3与亚硫酸钠在酸性条件下反应生成ClO2和硫酸钠等物质;
(2)二氧化氯(ClO2)沸点为11℃,NaClO3与亚硫酸钠在酸性条件下生成二氧化氯等物质, ClO2浓度过高时易发生分解引起爆炸,ClO2的沸点低,用冰水可以使ClO2冷凝为液体;
Ⅱ. (3)用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等,准确测量;
(4)溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点;
(5)根据氧化还原反应分析,有关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2)。
Ⅰ.(1)根据题给信息可知:NaClO3与亚硫酸钠在酸性条件下反应生成ClO2和硫酸钠等物质,则化学反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)二氧化氯(ClO2)沸点为11℃,NaClO3与亚硫酸钠在酸性条件下生成二氧化氯等物质, ClO2浓度过高时易发生分解引起爆炸,通入氮气,及时排出;ClO2的沸点低,用冰水可以使ClO2冷凝为液体,故答案为:降低ClO2的浓度,防止ClO2的浓度过高而发生分解,引起爆炸;冰水浴;
Ⅱ. (3)装置中玻璃液封管的作用是,防止ClO2逸出,使ClO2全部反应,准确测定ClO2的质量,故答案为:防止ClO2逸出,使ClO2全部反应,准确测定ClO2的质量;
(4)当滴入(最后)一滴标准液时,溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点,故答案为:溶液由蓝色变为无色,并且在30s内颜色不发生变化;
(5)VmLNa2S2O3溶液含有Na2S2O3物质的量n(Na2S2O3)=V10-3 L×cmol/L=cV10-3 mol.则:根据关系式: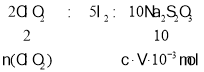 ,所以n(ClO2)=
,所以n(ClO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×cV10-3 mol,所以m(ClO2)=n(ClO2) M=
×cV10-3 mol,所以m(ClO2)=n(ClO2) M=![]() ×cV10-3 mol×67.5g/mol=1.35cV×10-2g,故答案为:1.35cV×10-2。
×cV10-3 mol×67.5g/mol=1.35cV×10-2g,故答案为:1.35cV×10-2。

 期末集结号系列答案
期末集结号系列答案【题目】以SO2、软锰矿(主要成分为MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4液和Mn3O4,主要实验步骤如下
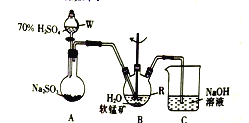
步骤I、如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2=MnSO4)。
步骤II、充分反应后,在不断搅拌下依次向仪器R中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅,
步骤III、过滤得MnSO4溶液
(1)仪器R的名称是_______。
(2)装置A用于制取SO2,反应的化学方程式为_________。
(3)装置B中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置C的作用是______________________。
(5)“步骤Ⅱ”中加入纯净MnO2的目的是_______________,用MnCO3调节溶液pH时,需调节溶液pH的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下表)
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀的pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的pH | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示

②反应温度超过80℃时,Mn3O4的产率开始降低,Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:______________________,真空干燥6小时得产品Mn3O4。
【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 46 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为 ( )
Si(s)+4HCl(g),该反应的反应热△H为 ( )
A.+412 kJ·mol-1B.-412 kJ·mol-1
C.+236 kJ·mol-1D.-236 kJ·mol-1