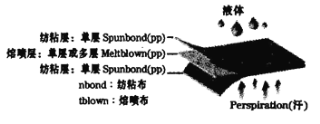
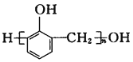
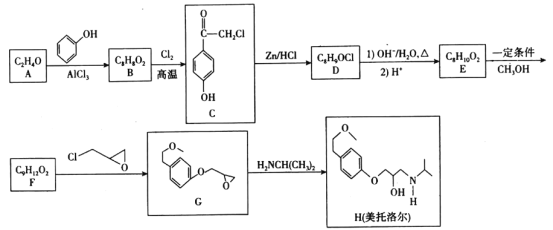
题目内容
【题目】常温下,向20 mL 0.1mol·L-1一元酸HA中滴加相同浓度的KOH溶液,溶液中由水电离的氢离子浓度随加入KOH溶液体积的变化如图所示。则下列说法错误的是
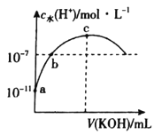
A.HA的电离常数约为10-5
B.b点溶液中存在:c(A-)=c(K+)
C.c点对应的KOH溶液的体积V=20 mL,c水(H+)约为7×10-6 mol·L-1
D.导电能力:c>a>b
【答案】D
【解析】
A.由a点可知,0.1mol/L一元酸HA中c水(H+)=c水(OH-)=1×10-11mol/L,则c(H+)=1×10-14÷10-11=1×10-3mol/L,则HA的电离常数 ,A选项正确;
,A选项正确;
B.b点溶液中c水(H+)=1×10-7mol/L,c点c水(H+)最大,则溶质恰好为KA,显碱性,a点显酸性,c点显碱性,则中间c水(H+)=1×10-7mol/L的b点恰好显中性,根据电荷守恒可得c(A-)+c(OH-)=c(K+)+c(H+),又c(OH-)=c(H+),则c(A-)=c(K+),B选项正确;
C.c点时加入的KOH的物质的量n(KOH)=20mL×0.1mol/L÷0.1mol/L=20mL,由HA的Ka=1×10-5,可得A-的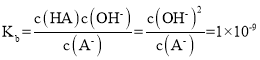 则c(A-)≈0.05mol/L,则c(OH-)≈7×10-6mol/L,在KA中c(OH-)都是由水电离处的,则c水(OH-)=c水(H+)≈7×10-6mol/L,C选项正确;
则c(A-)≈0.05mol/L,则c(OH-)≈7×10-6mol/L,在KA中c(OH-)都是由水电离处的,则c水(OH-)=c水(H+)≈7×10-6mol/L,C选项正确;
D.向一元弱酸中加入相同浓度的一元强碱,溶液的导电能力逐渐增强,则导电能力:c>b>a,D选项错误;
答案选D。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】下列有关实验操作与现象相匹配的是( )
选项 | 实验操作 | 现象 |
A | 将石蜡油分解得到的产物直接通入少量溴的CCl4溶液中 | 无明显现象 |
B | 将浓硫酸和蔗糖反应产生的气体通入少量的 | 气体全部被吸收且溶液紫红色变浅 |
C | 向淀粉碘化钾溶液中通入过量氯气 | 溶液先变蓝后褪色 |
D | 向 | 无沉淀生成 |
A.AB.BC.CD.D
【题目】X、Y、Z、W为短周期主族元素,它们的最高正化合价和原子半径如下表所示:
元素 | X | Y | Z | W |
最高正化合价 | +3 | +1 | +5 | +7 |
原子半径 | 0.082 | 0.186 | 0.110 | 0.099 |
则下列说法错误的是
A.X的最高价氧化物对应的水化物具有两性
B.ZW3分子中所有原子最外层均满足8e-结构
C.Y的一种氧化物可用作供氧剂,Z的一种氧化物可用作干燥剂
D.简单气态氢化物的热稳定性:W>Z>X