题目内容
图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物,A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,它们的转化关系如下:(有些反应的条件和部分产物未注明)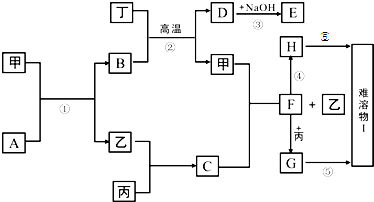
(1)上述反应中属于氧化还原反应的是
(2)写出下列物质化学式:B
(3)写出反应的化学方程式:A+甲
(4)H在空气中很容易被氧化成I,该过程的实验现象是

(1)上述反应中属于氧化还原反应的是
①②③
①②③
(填写序号)(2)写出下列物质化学式:B
Fe3O4
Fe3O4
,DAl2O3
Al2O3
,FFeCl2
FeCl2
;(3)写出反应的化学方程式:A+甲
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
| ||
(4)H在空气中很容易被氧化成I,该过程的实验现象是
先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
;将足量的CO2通入E溶液中,离子方程式是CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
.分析:A是一种常见的液态化合物,则A为H2O,B是具有磁性的氧化物,则B为Fe3O4,D和丁既能和酸反应又能和碱反应,则丁为Al,D为Al2O3,E为NaAlO2,乙在丙中燃烧产生苍白色火焰,则C为HCl,结合转化关系可知,甲为Fe,乙为H2,F为FeCl2,H在空气中很容易被氧化成I,则H为Fe(OH)2,I为Fe(OH)3,G为FeCl3,然后结合物质的性质及化学用语来解答.
解答:解:A是一种常见的液态化合物,则A为H2O,B是具有磁性的氧化物,则B为Fe3O4,D和丁既能和酸反应又能和碱反应,则丁为Al,D为Al2O3,E为NaAlO2,乙在丙中燃烧产生苍白色火焰,则C为HCl,结合转化关系可知,甲为Fe,乙为H2,F为FeCl2,H在空气中很容易被氧化成I,则H为Fe(OH)2,I为Fe(OH)3,G为FeCl3,
(1)①为Fe与水蒸气的反应,②为铝热反应,③为氧化铝与NaOH溶液的反应,④为氯化亚铁与NaOH溶液的反应,⑤为氢氧化亚铁被氧化生成氢氧化铁的反应,⑥为氯化铁和NaOH的反应,则①②③为氧化还原反应,故答案为:①②③;
(2)由上述分析可知,B为Fe3O4,D为Al2O3,F为FeCl2,故答案为:Fe3O4;Al2O3;FeCl2;
(3)A+甲反应的化学方程式为3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2;
(4)H被氧化为I,可以观察到的现象是先生成白色沉淀,迅速变为灰绿色,最终变为红褐色,足量的CO2通入E溶液中发生CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:先生成白色沉淀,迅速变为灰绿色,最终变为红褐色;CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
(1)①为Fe与水蒸气的反应,②为铝热反应,③为氧化铝与NaOH溶液的反应,④为氯化亚铁与NaOH溶液的反应,⑤为氢氧化亚铁被氧化生成氢氧化铁的反应,⑥为氯化铁和NaOH的反应,则①②③为氧化还原反应,故答案为:①②③;
(2)由上述分析可知,B为Fe3O4,D为Al2O3,F为FeCl2,故答案为:Fe3O4;Al2O3;FeCl2;
(3)A+甲反应的化学方程式为3Fe+4H2O(g)
| ||
| ||
(4)H被氧化为I,可以观察到的现象是先生成白色沉淀,迅速变为灰绿色,最终变为红褐色,足量的CO2通入E溶液中发生CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:先生成白色沉淀,迅速变为灰绿色,最终变为红褐色;CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
点评:本题考查无机物的推断,把握A、B、D、丁的性质及铝热反应为解答本题的突破口,侧重于金属及其化合物相互转化的考查,(3)中反应为解答的难点,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目