题目内容
【题目】(1)将饱和FeCl3溶液滴入沸水中,煮沸一段时间后,当溶液变为红褐色时,停止加热,所得的分散系称为 ,该反应的化学方程式为 ;
(2)如果FeCl3溶液中含有少量的NaCl,要除去NaCl得到纯净的FeCl3溶液,有下列方案:

试剂①是 ;试剂②是 (均填化学式);“操作Ⅰ”为 (填操作名称)。加入试剂②后发生反应的离子方程式为 ;
(3)已知:2FeCl3+2KI=2FeCl2+I2+2KCl要从反应后的溶液中分离得到纯净的单质碘,需采取的操作有 、 、 (填操作名称)
【答案】(1)Fe(OH)3胶体(1分);FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl(2分)
Fe(OH)3(胶体)+3HCl(2分)
(2)NaOH(2分)HCl(2分)过滤、洗涤(2分)
Fe(OH)3+3H+=Fe3++3H2O(2分)
(3)萃取;分液;蒸馏(3分)
【解析】
试题分析:(1)将饱和 FeCl3 溶液滴入沸水中 ,Fe3+ 会水解为红褐色的氢氧化铁胶体,其方程式为FeCl3+3 H2O![]() Fe(OH)3(胶体)+ 3 HCl
Fe(OH)3(胶体)+ 3 HCl
(2)FeCl3 溶液 ( 含 NaCl) 加入试剂①是氢氧化钠溶液 , 反应生成氢氧化铁沉淀 , 过滤得到 A 为 Fe(OH)3 ,氢氧化铁沉淀加入试剂②为盐酸,氢氧化铁溶解生成氯化铁溶液,所以试剂②是 HCl ,操作Ⅰ为过滤,加入试剂②后发生反应的离子方程式为Fe(OH)3 + 3H+ = Fe3+ + 3H2O
(3)在溶液中分离碘单质,可以先采用萃取的方法提取出来,分液分离,蒸馏提纯

 名校课堂系列答案
名校课堂系列答案【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
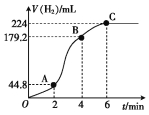
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。
