题目内容
【题目】已知溶液中:还原性HSO3->I-,氧化性IO3-> I2> SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
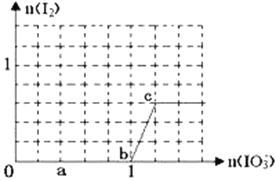
(1)写出a点反应的离子方程式__________________________;反应中还原剂是________;被还原的元素是________。
(2)写出b点到c点反应的离子方程式__________________________________________。
(3)当溶液中的I-为0.4 mol时,加入的KIO3为____________mol。
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为_____________。
【答案】 IO3-+ 3HSO3-=I-+ 3SO42-+3H+ NaHSO3 +5价I IO3-+5I-+6H+=3I2+3 H2O 1.12 mol或0.4 mol 2IO3-+ 5HSO3-=I2+ 5SO42-+H2O+3H+
【解析】

练习册系列答案
相关题目