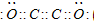题目内容
白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸.
(1)31g白磷与足量的氧气完全燃烧释放出745.5kJ的热量,请写出白磷燃烧的热化学反应方程式:
(2)已知白磷和氯酸溶液可发生如下反应:
(3)白磷有毒,在实验室可采用CuSO4溶液迸行处理,其反应为:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4该反应的氧化产物是
(1)31g白磷与足量的氧气完全燃烧释放出745.5kJ的热量,请写出白磷燃烧的热化学反应方程式:
P4(s)+5O2(g)=2P2O5(s),△H=-2982kJ/mol
P4(s)+5O2(g)=2P2O5(s),△H=-2982kJ/mol
(2)已知白磷和氯酸溶液可发生如下反应:
3
3
P4+10
10
HClO3+18
18
H2O
H2O
═10
10
HCl+12
12
H3PO4配平并完成上述反应方程式.(3)白磷有毒,在实验室可采用CuSO4溶液迸行处理,其反应为:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4该反应的氧化产物是
H3PO4
H3PO4
,若有1.1molP4反应,则有12
12
mol电子转移.分析:(1)根据31g白磷燃烧放出的热量计算1mol白磷燃烧放出的热量,从而根据热化学方程式的书写方法写出白磷燃烧的热化学反应方程式;
(2)根据氧化还原反应中得失电子数相等来配平氧化还原反应的方程式;
(3)失电子化合价升高的元素所在的反应物是还原剂,还原剂对应的产物是氧化产物,根据白磷的量和转移电子之间的关系式计算.
(2)根据氧化还原反应中得失电子数相等来配平氧化还原反应的方程式;
(3)失电子化合价升高的元素所在的反应物是还原剂,还原剂对应的产物是氧化产物,根据白磷的量和转移电子之间的关系式计算.
解答:解:(1)31g白磷与足量的氧气完全燃烧生成P2O5固体,释放出745.5kJ的热量,则1mol白磷完全燃烧放出的热量=
=2982kJ,所以白磷燃烧的热化学反应方程式为:P4(s)+5O2(g)=2P2O5(s),△H=-2982 kJ/mol,故答案为:P4(s)+5O2(g)=2P2O5(s),△H=-2982 kJ/mol;
(2)反应中P元素的化合价由0价升高到+5价,Cl元素的化合价由+5价降低到-1价,根据得失电子数目相等可知二者计量数之比为3:10,则结合质量守恒定律可知平衡后的化学方程式为3P4+10HClO3+18H2O=10HCl+12H3PO4,故答案为:3;10;18H2O;10;12;
(3)该反应中,Cu元素的化合价由+2价降低到+1价,部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,所以氧化产物是H3PO4,该反应中有11mol白磷参加反应,则转移电子的物质的量=24(5-0)mol=120mol,所以有1.1mol P4反应,则有12mol电子转移,故答案为:H3PO4;12.
| ||
| (31×4)g/mol |
(2)反应中P元素的化合价由0价升高到+5价,Cl元素的化合价由+5价降低到-1价,根据得失电子数目相等可知二者计量数之比为3:10,则结合质量守恒定律可知平衡后的化学方程式为3P4+10HClO3+18H2O=10HCl+12H3PO4,故答案为:3;10;18H2O;10;12;
(3)该反应中,Cu元素的化合价由+2价降低到+1价,部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,所以氧化产物是H3PO4,该反应中有11mol白磷参加反应,则转移电子的物质的量=24(5-0)mol=120mol,所以有1.1mol P4反应,则有12mol电子转移,故答案为:H3PO4;12.
点评:本题考查热化学反应方程式的书写、有关物质的量的计算等知识点,易错题是(3),注意该题中白磷既作氧化剂又作还原剂,且还原产物有两种,为易错点.

练习册系列答案
相关题目
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.