题目内容
【题目】(1)碳化硅(SiC)是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。下列各种晶体:①晶体硅 ②硝酸钾 ③金刚石 ④碳化硅 ⑤干冰 ⑥冰,它们的熔点由高到低的顺序是___________(填序号)。
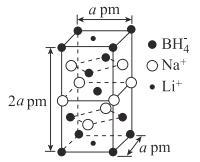
(2)下列离子晶体的立体构型示意图,如下图所示。

以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:_____________。
(3)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是______________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
【答案】③④①②⑥⑤ MN MN2 MN2 MN 离子键、非极性共价键 ![]()
【解析】
(1)熔点的一般规律:原子晶体>离子晶体>分子晶体,同种晶体根据晶体中微粒间的作用力大小分析;
(2)根据微粒所在晶胞位置,利用均摊法计算微粒数目之比,得到化学式;
(3)①根据FeS2晶体的晶体结构可知,晶体中阳离子与阴离子个数比为为1:1,所以晶体中存在亚铁离子与S22-,据此判断化学键;
②晶体结构A中相邻的阴、阳离子间的距离为a cm,所以晶胞的体积为a3cm3,晶胞中含有阴阳离子个数都是1/2,根据ρ=m/V算密度。
(1)晶体属于原子晶体的有①③④、离子晶体的有②、分子晶体的有⑤⑥.一般来说,原子晶体的熔点>离子晶体的熔点>分子晶体的熔点;对于原子晶体,原子半径越大,键长越长,键能越小,熔点越低,键长Si-Si>Si-C>C-C,相应键能Si-Si<Si-C<C-C,故它们的熔点:金刚石>碳化硅>晶体硅;分子晶体中有氢键的熔点较高,所以熔点:冰>干冰,所以它们的熔点由高到低的顺序是③④①②⑥⑤,故答案为:③④①②⑥⑤。
(2)A.M位于顶点,数目为4×1/8=1/2,N位于顶点,数目为4×1/8=1/2,微粒数目为1:1,即化学式为MN;
B.M分别位于晶胞的体心和顶点位置,体心占1个,顶点占8×1/8=1个,共2个,N分别位于面上和体内,面上4×1/2=2个,体内2个,共4个,即晶胞中两种微粒数目之比为1:2,化学式为MN2;
C.M位于顶点,数目为4×1/8=1/2,N位于体心,数目为1,化学式为MN2;
D.M位于顶点,数目为8×1/8=1,N位于体心,数目为1,化学式为MN,
故答案为:MN;MN2;MN2;MN。
(3)①根据FeS2晶体的晶体结构可知,晶体中阳离子与阴离子个数比为为1:1,所以晶体中存在亚铁离子与S22-,亚铁离子与S22-之间是离子键,S22-中存在非极性共价键,所以晶体中存离子键和(非极性)共价键,故答案为:离子键和(非极性)共价键。
②晶体结构A中相邻的阴、阳离子间的距离为a cm,所以晶胞的体积为a3cm3,晶胞中含有阴阳离子个数都是1/2,所以晶体的密度为ρ= g/cm3=
g/cm3=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)写出24号元素Cr的基态原子的电子排布式____________。
(2)元素e的基态原子的电子排布图:_______________。
(3)c有_____种运动不同的电子
(4)比较g、h、i三种元素的第一电离能的大小顺序:_______________(按由大到小的顺序排列,用元素符号表示)。
(5)图中o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________。
(6)第3周期主族元素按单质熔点高低的顺序如图所示,横坐标序号“8”代表______(填元素符号,下同)其中电负性最大的是____。