题目内容
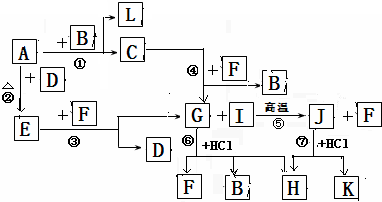
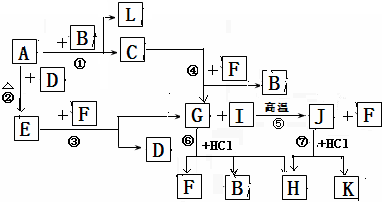
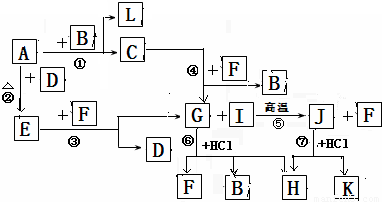
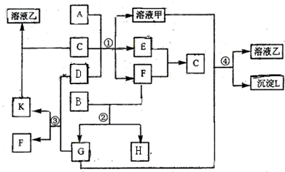
下图由短周期元素形成的物质之间的转化关系,其中A、D、L为单质,其他为化合物.其中化合物I、J、K中含有两种相同的元素,G和I的反应⑤是一种重要化工生产中的主要反应之一.B常温下为液态化合物,F是一种直线型的非极性气体分子.
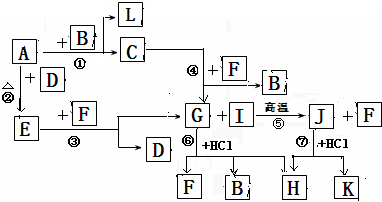
试回答下列有关问题:
(1)以上7个化学反应属于自身氧化还原反应的是
(2)在G、J、H中含有相同的元素是
(3)J的水溶液和F
(4)反应⑤的化学方程式是
(5)写出电解溶液H的阴极电极反应方程式是

试回答下列有关问题:
(1)以上7个化学反应属于自身氧化还原反应的是
③
③
(用编号①→⑦填写)(2)在G、J、H中含有相同的元素是
Na
Na
;(3)J的水溶液和F
能
能
填写”能”或”否”)发生反应,其理由是较强酸制较弱的酸
较强酸制较弱的酸
(4)反应⑤的化学方程式是
SiO2+Na2CO3
Na2SiO3+CO2↑
| ||
SiO2+Na2CO3
Na2SiO3+CO2↑
.
| ||
(5)写出电解溶液H的阴极电极反应方程式是
2H2O+2e-=2OH-+H2↑
2H2O+2e-=2OH-+H2↑
.分析:这道题唯一的突破口就是“G和I的反应⑤是一种重要化工生产中的主要反应之一”.然后看G和盐酸反应的生成物,为三种,所以初步鉴定,G为弱酸含氧盐.生成物为,H为氯酸盐,因为B常温下为液态化合物,所以是水B为水,F为二氧化碳; G是碳酸钠,B是水,F是二氧化碳,I是二氧化硅,J是硅酸钠,H是两个反应的共同产物,故为NaCl,K为H2SiO3;依据转化关系,C为NaOH,A、D、L为单质,A和B反应生成氢氧化钠和L,则A为Na,L为H2,A和D反应生成E,E和F生成碳酸钠和D,推断为E为Na2O2,D为O2,依据判断出的物质分析回答问题.
解答:解:“G和I的反应⑤是一种重要化工生产中的主要反应之一”.然后看G和盐酸反应的生成物,为三种,所以初步鉴定,G为弱酸含氧盐.生成物为,H为氯酸盐,因为B常温下为液态化合物,所以是水B为水,F为二氧化碳; G是碳酸钠,B是水,F是二氧化碳,I是二氧化硅,J是硅酸钠,H是两个反应的共同产物,故为NaCl,K为H2SiO3;依据转化关系,C为NaOH,A、D、L为单质,A和B反应生成氢氧化钠和L,则A为Na,L为H2,A和D反应生成E,E和F生成碳酸钠和D,推断为E为Na2O2,D为O2,
(1)根据推断可知①是置换反应,②是化合反应,③是氧化还原反应,④是复分解反应,⑤是复分解反应,⑥是复分解反应,⑦是复分解反应,所以发生自身氧化还原反应的是过氧化钠和二氧化碳的反应为③,故答案为:③;
(2)在G为Na2CO3、J为Na2SiO3、H为NaCl,所以三种物质中含有相同的元素是Na,故答案为:Na;
(3)J(Na2SiO3)的水溶液和F(CO2)反应生成碳酸钠和硅酸,反应的理由是较强酸制较弱的酸,故答案为:能 较强酸制较弱的酸;
(4)反应⑤是二氧化硅和碳酸钠在高温条件下反应生成硅酸钠和二氧化碳,反应的化学方程式是:SiO2+Na2CO3
Na2SiO3+CO2↑;故答案为:SiO2+Na2CO3
Na2SiO3+CO2↑;
(5)电解溶液H(NaCl)的阴极电极反应方程式是:2H2O+2e-=2OH-+H2↑;故答案为:2H2O+2e-=2OH-+H2↑.
(1)根据推断可知①是置换反应,②是化合反应,③是氧化还原反应,④是复分解反应,⑤是复分解反应,⑥是复分解反应,⑦是复分解反应,所以发生自身氧化还原反应的是过氧化钠和二氧化碳的反应为③,故答案为:③;
(2)在G为Na2CO3、J为Na2SiO3、H为NaCl,所以三种物质中含有相同的元素是Na,故答案为:Na;
(3)J(Na2SiO3)的水溶液和F(CO2)反应生成碳酸钠和硅酸,反应的理由是较强酸制较弱的酸,故答案为:能 较强酸制较弱的酸;
(4)反应⑤是二氧化硅和碳酸钠在高温条件下反应生成硅酸钠和二氧化碳,反应的化学方程式是:SiO2+Na2CO3
| ||
| ||
(5)电解溶液H(NaCl)的阴极电极反应方程式是:2H2O+2e-=2OH-+H2↑;故答案为:2H2O+2e-=2OH-+H2↑.
点评:本题考查了无机物质的相互转化关系,物质性质的应用,主要考查转化关系的综合推断能力,反应类型的判断,碳及其化合物、硅及其化合物、钠及其化合物性质的应用,电解原理的电极反应书写,题目较难,需要熟练掌握物质性质,较强的综合推断能力.

练习册系列答案
相关题目
 (2009?辽宁)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)
(2009?辽宁)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)