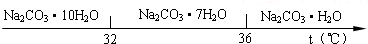题目内容
向含有Mg2+、Fe2+、NH4+、Al3+的溶液中,加入过量的NaOH溶液,加热并搅拌,再加入过量盐酸,溶液中减少的阳离子是( )A.Mg2+
B.Fe2+
C.NH4+
D.Al3+
解答:解:A.加入过量的NaOH镁离子全部转化为Mg(OH)2沉淀,再加入过量盐酸,又生成Mg2+,故A错误;
B.铁离子全部转化为Fe(OH)2沉淀,加热被氧化成Fe3+,Fe2+明显减少,故B正确;
C.铵根离子和氢氧根离子反应转化为氨水,加热后生成氨气离开了溶液,NH4+明显减少,故C正确;
D.铝则转化成了偏铝酸根离子,再加入过量盐酸,又生成Al3+,故D错误.
故选BC.
点评:本题考查离子反应发生的条件及其应用,离子的特性.难度中等.

 快乐小博士巩固与提高系列答案
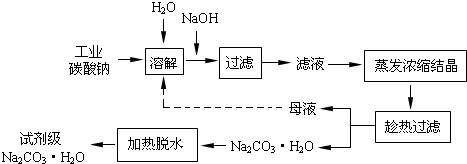
快乐小博士巩固与提高系列答案(14分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ、25℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为:
▲ 。
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
pH=8时,c(Mg2+):c(Fe3+)= ▲ 。
(2)“趁热过滤”时的温度应控制在 ▲ 。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。
请你分析实际工业生产中是否可行 ▲ ,并说明理由:
▲ 。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 532.36kJ·mol-1
Na2CO3·10H2O (s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 ▲ 。
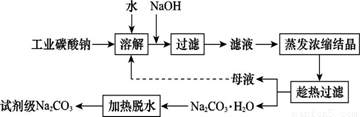
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
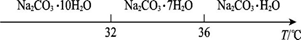
Ⅱ.有关物质的溶度积如下
|
物质 |
CaCO3 |
MgCO3 |
Ca(0H)2 |
Mg(OH)2 |
Fe(OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g)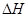 =+532.36 kJ·mol-1
=+532.36 kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g) 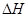 =+473.63
kJ·mol-1
=+473.63
kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式: 。
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:

Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
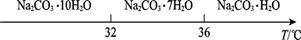
Ⅱ.有关物质的溶度积如下
|
物质 |
CaCO3 |
MgCO3 |
Ca(0H)2 |
Mg(OH)2 |
Fe(OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) =+532.36 kJ·mol-1
=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)  =+473.63
kJ·mol-1
=+473.63
kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式: 。
(14分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
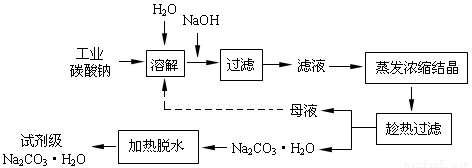
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:

Ⅱ、25℃时有关物质的溶度积如下:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为:
▲ 。
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
pH=8时,c(Mg2+):c(Fe3+)= ▲ 。
(2)“趁热过滤”时的温度应控制在 ▲ 。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。
请你分析实际工业生产中是否可行 ▲ ,并说明理由:
▲ 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 532.36kJ·mol-1
Na2CO3·10 H2O (s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 ▲ 。