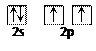题目内容
已知X、Y、Z为三种由短周期元素构成的粒子,每摩粒子都有10mol电子,其结构特点如下:
现有A、B、C、D、E、F、G、H、I、J、K等物质,它们之间的相互反应转化关系如下图所示下图所示:
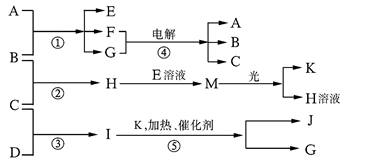
已知物质A由X、Z构成, B、C、D、K都是单质,G为无色液体,I的水溶液呈碱性,反应①~⑤都是用于工业生产的反应,请回答下列问题:?
(1) A的电子式为 ;D的结构式为 。
(2)物质B的组成元素在元素周期表中的位置是 。
(3)反应①的化学方程式为 。?
反应④离子方程式为 。?
(4)H和I反应的生成物的水溶液呈酸性,其原因是 (用一个离子反应方程式表示)
(5)已知每生成1mol I放出46.0kJ的热量,则反应③的热化学方程式为 。
| | X | Y | Z |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 1个单位正电荷 | 0 | 1个单位负电荷 |

已知物质A由X、Z构成, B、C、D、K都是单质,G为无色液体,I的水溶液呈碱性,反应①~⑤都是用于工业生产的反应,请回答下列问题:?
(1) A的电子式为 ;D的结构式为 。
(2)物质B的组成元素在元素周期表中的位置是 。
(3)反应①的化学方程式为 。?
反应④离子方程式为 。?
(4)H和I反应的生成物的水溶液呈酸性,其原因是 (用一个离子反应方程式表示)
(5)已知每生成1mol I放出46.0kJ的热量,则反应③的热化学方程式为 。
(1)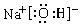 N ≡ N
N ≡ N
(2)第三周期第ⅦA族
(3)Cl2 + 2NaOH=" NaCl" +NaClO+ H2O
2Cl-+2H2O 2OH-+Cl2↑ + H2↑
2OH-+Cl2↑ + H2↑
(4)NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(5)N2(g)+3H2(g)=2NH3(g) △H=" —" 92.0kJ
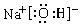 N ≡ N
N ≡ N(2)第三周期第ⅦA族
(3)Cl2 + 2NaOH=" NaCl" +NaClO+ H2O
2Cl-+2H2O
 2OH-+Cl2↑ + H2↑
2OH-+Cl2↑ + H2↑(4)NH4++H2O
 NH3·H2O+H+
NH3·H2O+H+(5)N2(g)+3H2(g)=2NH3(g) △H=" —" 92.0kJ
结合10电子微粒及所给信息可知,X、Y、Z分别为Na+、NH3、OH-;进而可知A为NaOH,G为H2O;
F与水电解生成NaOH及B、C,可知F为NaCl:2NaCl+2H2O 2NaOH+Cl2↑ + H2↑,B、C分别为Cl2和H2;
2NaOH+Cl2↑ + H2↑,B、C分别为Cl2和H2;
氢气C与单质D可化合为碱性物质I:N2+3H2 2NH3;结合氨气的性质及它与K反应的条件“催化剂、加热”,可知K为氧气:4NH3+5O2
2NH3;结合氨气的性质及它与K反应的条件“催化剂、加热”,可知K为氧气:4NH3+5O2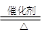 4NO+6H2O,J为NO;
4NO+6H2O,J为NO;
(1)NaOH为离子化合物,其电子式为: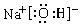 ;氮气分子内为氮氮三键:N ≡ N
;氮气分子内为氮氮三键:N ≡ N
(2)氯元素属于第三周期第ⅦA族
(3)Cl2 + 2NaOH=" NaCl" +NaClO+ H2O 2Cl-+2H2O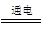 2OH-+Cl2↑ + H2↑
2OH-+Cl2↑ + H2↑
(4)HCl+NH3===NH4Cl,NH4Cl为强酸弱碱盐,水解呈酸性:NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(5)对反应N2+3H2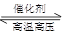 2NH3来讲,生成2mol氨气可放出92.0kJ的热量,对应的热化学方程式为:N2(g)+3H2(g)=2NH3(g) △H=—92.0kJ
2NH3来讲,生成2mol氨气可放出92.0kJ的热量,对应的热化学方程式为:N2(g)+3H2(g)=2NH3(g) △H=—92.0kJ
F与水电解生成NaOH及B、C,可知F为NaCl:2NaCl+2H2O
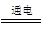 2NaOH+Cl2↑ + H2↑,B、C分别为Cl2和H2;
2NaOH+Cl2↑ + H2↑,B、C分别为Cl2和H2;氢气C与单质D可化合为碱性物质I:N2+3H2
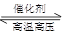 2NH3;结合氨气的性质及它与K反应的条件“催化剂、加热”,可知K为氧气:4NH3+5O2
2NH3;结合氨气的性质及它与K反应的条件“催化剂、加热”,可知K为氧气:4NH3+5O2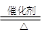 4NO+6H2O,J为NO;
4NO+6H2O,J为NO;(1)NaOH为离子化合物,其电子式为:
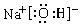 ;氮气分子内为氮氮三键:N ≡ N
;氮气分子内为氮氮三键:N ≡ N(2)氯元素属于第三周期第ⅦA族
(3)Cl2 + 2NaOH=" NaCl" +NaClO+ H2O 2Cl-+2H2O
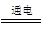 2OH-+Cl2↑ + H2↑
2OH-+Cl2↑ + H2↑(4)HCl+NH3===NH4Cl,NH4Cl为强酸弱碱盐,水解呈酸性:NH4++H2O
 NH3·H2O+H+
NH3·H2O+H+(5)对反应N2+3H2
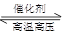 2NH3来讲,生成2mol氨气可放出92.0kJ的热量,对应的热化学方程式为:N2(g)+3H2(g)=2NH3(g) △H=—92.0kJ
2NH3来讲,生成2mol氨气可放出92.0kJ的热量,对应的热化学方程式为:N2(g)+3H2(g)=2NH3(g) △H=—92.0kJ
练习册系列答案
相关题目