题目内容
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
| A.(y-2x)/a mol·L-1 | B.(y-x)/a mol·L-1 |
| C.(2y-2x)/a mol·L-1 | D.(2y-4x)/a mol·L-1 |
D
解析试题分析:设每份中的Ba2+离子的物质的量为m,Cl-离子的物质的量为n
由Ba2++SO42-=BaSO4↓
1 1
m x
解得m=x
Cl-+Ag+=AgCl↓
1 1
n y
解得n=y
设每份中的钠离子的物质的量为z,BaCl2和NaCl的混合溶液不显电性
则x×2+z=y
解得z=(y-2x)mol
则原溶液中的钠离子为(y-2x)mol×2=(2y-4x)mol
所以c(Na+)=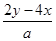 mol/L
mol/L
因此醇答案选D。
考点:考查根据离子方程式进行物质的量浓度的有关计算

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.8 g甲烷含有的共价键数约为NA |
| B.常温常压下,22.4 L二氧化碳原子总数为3NA |
| C.1 mol Fe与足量稀HNO3反应,转移3 NA个电子 |
| D.3.2g硫(结构见图)含S-S键的数目为0.8NA |
下列关于1 mol/L Na2SO4溶液的说法正确的是。
| A.溶液中含有1 mol Na2SO4 |
| B.1 mol Na2SO4溶于1 L蒸馏水中 |
| C.将322 g Na 2SO4·10H2O溶于少量水后再稀释到1000 mL |
| D.将322 g Na 2SO4·10H2O溶于少量水后再稀释到500 mL |
下列有关化学用语或名称表达正确的是
A.Mg的原子结构示意图: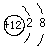 |
B.乙炔的分子结构模型示意图: |
C.H2O2的电子式: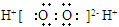 |
D.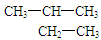 的名称:2-甲基丁烷 的名称:2-甲基丁烷 |
科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是( )
| A.原子数 | B.分子数 | C.体积 | D.物质的量 |
右图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是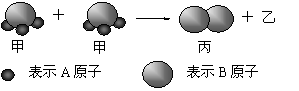
| A.化学反应中分子的种类发生了改变 |
| B.该反应类型是分解反应 |
| C.反应生成的丙物质属于单质 |
| D.根据阿佛加德罗定律可推知,1个乙分子中含有2个A原子 |
如图是某学校实验室从化学试剂商店买圆的硫酸试剂标签上的部分内容,据此判断下列说法错误的是
| A.该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 |
| B.取10 mL该硫酸于烧杯中,再加18.4 mL的水,可配得49%的硫酸 |
| C.配制200 mL4.6 mol/L的稀硫酸需取该硫酸50 mL |
| D.该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol/L |
配制100mL 2 mol/L的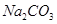 溶液,应称量
溶液,应称量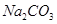 的质量为
的质量为
| A.21.2g | B.20.1g | C.212g | D.201g |
以NA表示阿伏伽德罗常数的数值,下列说法不正确的是( )
| A.1 L1mol/L H2SO4,含有2NA个H+ |
| B.500mL2mol/L盐酸比100mL2mol/L硫酸的导电性强 |
| C.1mol Na2S2,含NA个共价键 |
| D.标准状况下,3.36 LSO2的质量约为9.6g |