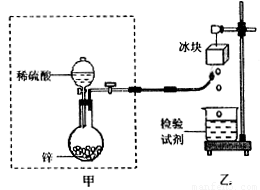
题目内容
氢气在空气中燃烧生成水,这是人人皆知的常识。但有同学提出:类似钠在空气中燃烧生成过氧化钠,氢气在空气中燃烧会不会生成H2O2呢?根据我们的经验:双氧水不稳定,即使是有少量的双氧水生成,也会因火焰的高温而分解。某课外兴趣小组设计了下图实验装置验证氢气在空气中燃烧的产物中是否有双氧水。请回答下列问题: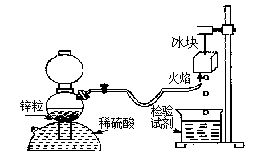
(1)已知,I2遇淀粉显蓝色。甲同学从下列试剂中选择了一种检验试剂,成功地检测到了双氧水的存在,该试剂是______。
A.淀粉溶液 B.氯化钠溶液
C.氢氧化钠溶液 D.淀粉KI酸性溶液
甲同学检验时证明有双氧水产生的现象是________________;冰块的作用是____________。
(2)乙同学用较稀的酸性高锰酸钾溶液作为检验试剂,实验时观察到酸性高锰酸钾溶液褪色(生成Mn2+),由此也证明了氢气燃烧有双氧水生成,写出该反应的离子方程式:______________。
(3)丙同学对乙同学的检验方案提出质疑:若锌粒中杂质与稀硫酸反应有少量H2S、SO2等气体生成,也会使酸性高锰酸钾溶液褪色,从而导致错误的判断。为消除丙同学的疑虑,请你提出对上述实验装置的改进建议: ___________________。
(4)除上述检验双氧水存在的方案外,请你再列举简便可行的验证方案。
(1)D ;淀粉KI酸性溶液变蓝色 ; 降低温度以减少过氧化氢的分解
(2)
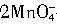 +6H++5H2O2=2Mn2++5O2↑+8H2O
+6H++5H2O2=2Mn2++5O2↑+8H2O(3)将制出的气体通过足量的氢氧化钠溶液(或碱石灰),再干燥后,点燃
(4)加入二氧化锰粉末观察是否产生气泡或滴加含NaOH的酚酞溶液,观察溶液是否褪色。(该问根据上述分析也可以有其他答案,只要严密可行即可)
【试题分析】
解析:设计检验双氧水是否存在的方案可以从四个方面入手:一是从双氧水具有氧化性入手,双氧水能在酸性条件下氧化I-生成I2,而已知I2遇淀粉变蓝色;二是从双氧水具有还原性入手,H2O2与酸性高锰酸钾溶液反应,作还原剂,生成氧气;三是从它的漂白性入手,根据中学教材实验知,过氧化钠与酚酞试液反应,溶液先变红后褪色,因此检验双氧水可以用含氢氧化钠的酚酞溶液检验;四是还可以利用双氧水的不稳定性,在二氧化锰催化作用下分解进行检验。
根据该题中实验装置图中的信息,用锌粒与稀硫酸反应制氢气,锌粒中可能含有金属硫化物,因此H2中可能含有杂质气体H2S、SO2等,两者都能与强碱溶液反应,可以用碱性溶液除去。

练习册系列答案
相关题目
(14分)
I(8分)用如图所示装置进行实验,将A中液体加入到B中,在甲装置内制备某种气体,在乙装置对甲中产生的气体进行性质实验。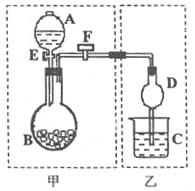
(1)若要检查甲装置的气密性,具体的操作步骤为 。
(2)若在分液漏斗A中盛浓盐酸:
①若B中盛有某种紫黑色固体,C中盛有KI淀粉溶液,旋开F.E后,C中的溶液变蓝色,则B中固体为 ;继续通气体于C中,足够长的时间后,发现C中溶液蓝色褪去,这是因为在溶液中的I2被氧化为HIO3,写出此反应的化学方程式 。
②若B中盛有某种无色液体,当C中盛石蕊试液时,旋开F.E后,C中的溶液变红色,当C中盛品红溶液时,旋开F.E后,品红溶液不褪色,则B中无色液体为 。
当C中盛 溶液时,写出C中反应的化学方程式 。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险: 。
溶液时,写出C中反应的化学方程式 。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险: 。
Ⅱ(6分)氢气在空气中燃烧生成水:但有的同学会提出:氢气在空气中燃烧会不会生成H2O2;根据我们的经验,H2O2不稳定,即便是有少量H2O2生成,也会因火焰的高温而分解。某课外兴趣小组利用上题中的甲装置设计了如下图所示装置验证H2在空气中燃烧的产物中是否含有H2O2。试填空:
(1)甲同学从下列试剂中选择了一种检验试剂,成功检测到了H2O2的存在,该试剂是
| A.淀粉溶液 | B.氯化钠溶液 |
| C.氢氧化钠溶液 | D.淀粉碘化钾酸性溶液 |
反应的离子方程式为 。
(2)乙同学用较稀的酸性高锰酸钾溶液作为检验试剂,实验时观察到高锰酸钾溶液褪色(生成Mn2+),由此也证明了氢气燃烧有H2O2,写出该反应的离子方程式:
。



 溶液时,写出C中反应的化学方程式
。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险:
。
溶液时,写出C中反应的化学方程式
。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险:
。