题目内容
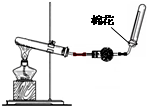
 如图是实验室制取氨气的气体发生装置,回答下列问题:
如图是实验室制取氨气的气体发生装置,回答下列问题:(1)收集氨气的方法是
(2)写出实验室制取氨气的化学方程式
(3)若有5.35gNH4Cl参加反应,则产生的NH3在标准状况下的体积为
分析:(1)依据氨气是比空气轻的极易溶于水的气体分析判断收集方法,遇到湿润的红色石蕊试纸变蓝色可以用来检验氨气是否收集满;
(2)实验室制备氨气是利用固体氯化和氢氧化钙加热反应生成氨气;
(3)依据化学方程式定量关系计算得到气体物质的量,结合n
计算标准状况下的体积;
(2)实验室制备氨气是利用固体氯化和氢氧化钙加热反应生成氨气;
(3)依据化学方程式定量关系计算得到气体物质的量,结合n
| V |
| 22.4 |
解答:解:(1)氨气是比空气轻的极易溶于水的气体分析判断收集方法应为向下排气法,收集氨气的方法是向下排空气法.遇到湿润的红色石蕊试纸变蓝色可以用来检验氨气是否收集满;验证氨气是否已经收集满的方法是:用湿润的红色石蕊试纸靠近瓶口,若变蓝色,说明收集满瓶;
故答案为:用湿润的红色石蕊试纸靠近瓶口,若变蓝色,说明收集满瓶;
(2)实验室制备氨气是利用固体氯化和氢氧化钙加热反应生成氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(3)依据化学方程式计算生成氨气物质的量,5.35gNH4Cl物质的量=
=0.1mol;
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
2 2
0.1mol 0.1mol
则标准状况生成氨气体积=0.1mol×22.4L/mol=2.24L;
故答案为:2.24L;
故答案为:用湿润的红色石蕊试纸靠近瓶口,若变蓝色,说明收集满瓶;
(2)实验室制备氨气是利用固体氯化和氢氧化钙加热反应生成氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(3)依据化学方程式计算生成氨气物质的量,5.35gNH4Cl物质的量=
| 5.35g |
| 53.5g/mol |
2NH4Cl+Ca(OH)2
| ||
2 2
0.1mol 0.1mol
则标准状况生成氨气体积=0.1mol×22.4L/mol=2.24L;
故答案为:2.24L;
点评:本题考查了实验室制备氨气的原理和方法,氨气的性质分析,实验基本操作是关键,题目较简单.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
 (1)按要求完成下列表格:
(1)按要求完成下列表格:
| 实验要求 | 化学试剂(写化学式) | 主要操作 |
| 除去NO气体中混有的NO2 | ______ | ______ |
| 除去SiO2固体中混有的Al2O3 | ______ | ______ |
| 除去Na2CO3溶液中的NaHCO3 | ______ | - |
| 除去NaCl溶液中混有的I2水溶液 | ______ | ______ |
①用化学方程式表示实验室制取氨气的反应原理______.
②若试管内只装有碳酸氢铵固体,需把加热所得气体进行适当处理可获得纯净的氨气,则在球形干燥管中装放的固体药品名称为
______(装置部分夹持仪器已省去).
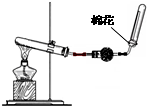
 如图是实验室制取氨气的气体发生装置,请
如图是实验室制取氨气的气体发生装置,请 (1)按要求完成下列表格:
(1)按要求完成下列表格: