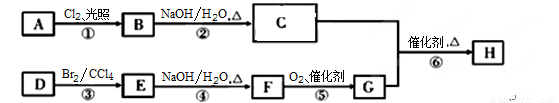
题目内容
(6分)按要求回答下列问题:
(1)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
(2)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应生成正盐时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的热化学方程式
_____________ 。
(3)已知下列反应的焓变:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) △H2=-393.5kJ/mol
③2 H2(g)+O2(g) =2H2O(l) △H3=-285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=
(1)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452.8kJ/mol
(2)1/2H2SO4(aq)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
(3)ΔH=-202.5KJ/mol
【解析】考查热化学方程式的书写及反应热的计算。
(1)5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则2mol甲醇燃烧放出的热量是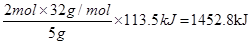 ,所以热化学方程式为
,所以热化学方程式为
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452.8kJ/mol。
(2)热化学方程式为H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol。
(3)根据盖斯定律可知②×2+③-1即得到2C(s)+2H2(g)+O2(g) =CH3COOH(l),所以反应热是-393.5kJ/mol×2-285.8kJ/mol+870.3kJ/mol=-202.5KJ/mol。

(8分) 现有下列晶体, 请按要求回答相应问题。(前六个小题用编号填空)
| A.干冰 | B.晶体硅 | C.氩 | D.二氧化硅 E.氯化铵 |
(2)属于非电解质且熔化时只需破坏分子间作用力的是 。
(3)属于分子晶体,且分子为直线型结构的是 。
(4)不含任何化学键的晶体是 。
(5)固态时不导电,熔融状态下能导电的是 。
(6)含有离子键、共价键、配位键的化合物是 。
(7)已知石墨在一定条件下可将D还原成B,反应方程式为SiO2+2C======Si+2CO,若石墨中C—C的键能为a,SiO2中Si—O的键能为b,晶体硅中Si—Si的键能为c,CO的键能为d,请用a、b、c、d表示生成晶体硅时的反应热△H= 。K^S*5U.C#O