题目内容
【题目】现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间的转化如图所示(金属B的氧化物可用作耐火材料,图中某些反应的产物及条件没有全部标出)。
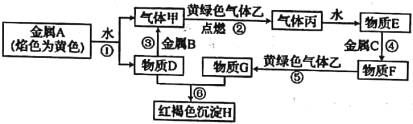
回答下列问题:
(1)金属单质A、B、C分别为_____、_________、_________ (写化学式)。
(2)反应②的实验现象是________________________。
(3)反应③的化学方程式为___________。
(4)反应⑤的离子方程式为___________。
(5)⑥的反应类型是___________。
【答案】 Na Al Fe 燃烧、火焰呈苍白色 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Cl2+2Fe=2C1-+2Fe3+ 复分解反应
【解析】金属A颜色反应为黄色证明为Na,与水反应生成气体甲为![]() ,D为NaOH,金属B和氢氧化钠溶液反应生成氢气,说明B为Al,黄绿色气体乙为
,D为NaOH,金属B和氢氧化钠溶液反应生成氢气,说明B为Al,黄绿色气体乙为![]() ,与氢气反应生成丙为HCl,溶于水得到E为盐酸,物质D(氢氧化钠)和G反应生成红褐色沉淀H为
,与氢气反应生成丙为HCl,溶于水得到E为盐酸,物质D(氢氧化钠)和G反应生成红褐色沉淀H为![]() ,说明G中含有
,说明G中含有![]() ,金属C与盐酸反应得到F,F与氯气反应得到G,可推知C为Fe,F为
,金属C与盐酸反应得到F,F与氯气反应得到G,可推知C为Fe,F为![]() ,G为
,G为![]() ,
,
(1)由上述分析可以知道, 金属单质A、B、C分别为Na、Al 、Fe。答案是: Na、 Al
(2)氢气在氯气中燃烧发出苍白色火焰。答案是: 燃烧、火焰呈苍白色
(3)铝与氢氧化钠反应生成偏铝酸钠和氢气,方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑答案是: 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(4)氯气能把Fe2+氧化为Fe3+,反应⑤的离子方程式为:Cl2+2Fe=2C1-+2Fe3+答案是: Cl2+2Fe=2C1-+2Fe3+
(5)三氯化铁与氢氧化钠生成氢氧化铁沉淀和氯化钠,属于复分解反应。答案是:复分解反应

【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。

①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率______________(填“升高”或“降低”),△H_____0(填“>”或“<”)。
②根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=______________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
③若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
【题目】已知反应 Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某同学按表进行实验,最先出现浑浊的一组应该是( )
加3%Na2S2O3/mL | 加1:5的H2SO4/滴 | 温度/℃ | |
A | 5 | 25 | 25 |
B | 5 | 15 | 35 |
C | 5 | 25 | 45 |
D | 5 | 15 | 45 |
A.A
B.B
C.C
D.D
