题目内容
已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=" ZnO(s)+" Hg(l)的ΔH为
| A.+519.4kJ·mol-1 | B.+259.7 kJ·mol-1 | C.-259. 7 kJ·mol-1 | D.-519.4kJ·mol-1 |
C
解析试题分析:根据盖斯定律,反应Zn(s)+ HgO(s)=" ZnO(s)+" Hg(l)是由反应①2Zn(s)+O2(g)="2ZnO(s)" ΔH=-701.0kJ·mol-1与反应②2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1做差除以2得到的,所以ΔH=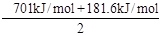 ="-259." 7 kJ·mol-1。答案选C。
="-259." 7 kJ·mol-1。答案选C。
考点:盖斯定律
点评:盖斯定律:定压定容条件下,任意一个反应其总反应的热效应只与反应的始态和终态有关而与反应的路程无关。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
