题目内容
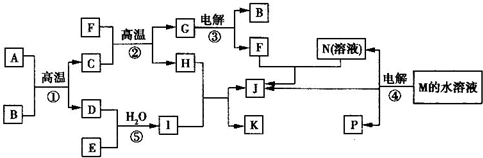
已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去.试回答下列问题:
(1)A的化学式为______;工业上反应①所用的设备名称是______.
(2)反应②的实验中,还需用到的药品是______、______(填药品名称).
(3)反应④的化学方程式为______ Cl2↑+H2↑+2NaOH

【答案】分析:高中阶段常见的工业生产有硫酸工业、合成氨工业、硝酸工业、硅酸盐工业.A的相对分子质量为120,且在高温下与B反应,推知反应①是硫酸工业中煅烧FeS2的反应,B、D为气体,所以A为FeS2,B为O2,C为Fe2O3,D为SO2,E为分子中原子个数之比为1:1的液体,能氧化SO2,故E为H2O2,I为H2SO4.Fe2O3在高温下与F(Al)发生铝热反应生成G(Al2O3)和H(Fe).电解熔融Al2O3得到O2、F(Al),Fe与H2SO4反应生成FeSO4与H2,J为气体,则K为FeSO4,J为H2.M的焰色反应为黄色,含有钠元素,电解产生三种物质N、P与H2,故M为NaCl,P为气体,则N为NaOH、P为Cl2.
由于生成的Cl2与H2相遇容易发生爆炸,且Cl2与NaOH溶液反应会导致氢氧化钠不纯,电解饱和食盐水使用阳离子交换膜阻止上述情况的发生.Cl2与NaOH溶液反应生成的NaClO具有强氧化性,在溶液能将Fe2+氧化为Fe3+,从而生成Fe(OH)3沉淀,ClO-被还原为Cl-,再根据电荷守恒、电子转移守恒、原子守恒配平可得反应的离子方程式.
解答:解:高中阶段常见的工业生产有硫酸工业、合成氨工业、硝酸工业、硅酸盐工业.A的相对分子质量为120,且在高温下与B反应,推知反应①是硫酸工业中煅烧FeS2的反应,B、D为气体,所以A为FeS2,B为O2,C为Fe2O3,D为SO2,E为分子中原子个数之比为1:1的液体,能氧化SO2,故E为H2O2,I为H2SO4.Fe2O3在高温下与F(Al)发生铝热反应生成G(Al2O3)和H(Fe),电解熔融Al2O3得到O2、F(Al),Fe与H2SO4反应生成FeSO4与H2,J为气体,则K为FeSO4,J为H2.M的焰色反应为黄色,含有钠元素,电解产生三种物质N、P与H2,故M为NaCl,P为气体,则N为NaOH、P为Cl2.
(1)由上述分析可知,A为FeS2,工业上反应①所用的设备名称是沸腾炉,故答案为:FeS2;沸腾炉;
(2)反应②的实验是铝热反应,还需用到的药品是镁条、氯酸钾,故答案为:镁条;氯酸钾;
(3)反应④是电解饱和食盐水,化学方程式为:2NaCl+2H2O Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;
由于生成的Cl2与H2相遇容易发生爆炸,且Cl2与NaOH溶液反应会导致氢氧化钠不纯,电解饱和食盐水使用阳离子交换膜阻止上述情况的发生,
故答案为:2NaCl+2H2O Cl2↑+H2↑+2NaOH;防止生成的Cl2与H2相遇容易发生爆炸,避免Cl2与NaOH溶液反应会导致氢氧化钠不纯;
Cl2↑+H2↑+2NaOH;防止生成的Cl2与H2相遇容易发生爆炸,避免Cl2与NaOH溶液反应会导致氢氧化钠不纯;
(4)Cl2与NaOH溶液反应生成的NaClO具有强氧化性,将Fe2+氧化为Fe3+,从而生成Fe(OH)3沉淀,ClO-被还原为Cl-,再根据电荷守恒、电子转移守恒、原子守恒配平得:3ClO-+6Fe2++3H2O=2Fe(OH)3+4Fe3++3Cl-,
故答案为:3ClO-+6Fe2++3H2O=2Fe(OH)3+4Fe3++3Cl-.
点评:本题考查了无机物推断,主要涉及中学常见工业生产,综合性较强,(4)中离子方程式的书写为易错点、难点,注意利用守恒进行判断并配平.
由于生成的Cl2与H2相遇容易发生爆炸,且Cl2与NaOH溶液反应会导致氢氧化钠不纯,电解饱和食盐水使用阳离子交换膜阻止上述情况的发生.Cl2与NaOH溶液反应生成的NaClO具有强氧化性,在溶液能将Fe2+氧化为Fe3+,从而生成Fe(OH)3沉淀,ClO-被还原为Cl-,再根据电荷守恒、电子转移守恒、原子守恒配平可得反应的离子方程式.
解答:解:高中阶段常见的工业生产有硫酸工业、合成氨工业、硝酸工业、硅酸盐工业.A的相对分子质量为120,且在高温下与B反应,推知反应①是硫酸工业中煅烧FeS2的反应,B、D为气体,所以A为FeS2,B为O2,C为Fe2O3,D为SO2,E为分子中原子个数之比为1:1的液体,能氧化SO2,故E为H2O2,I为H2SO4.Fe2O3在高温下与F(Al)发生铝热反应生成G(Al2O3)和H(Fe),电解熔融Al2O3得到O2、F(Al),Fe与H2SO4反应生成FeSO4与H2,J为气体,则K为FeSO4,J为H2.M的焰色反应为黄色,含有钠元素,电解产生三种物质N、P与H2,故M为NaCl,P为气体,则N为NaOH、P为Cl2.
(1)由上述分析可知,A为FeS2,工业上反应①所用的设备名称是沸腾炉,故答案为:FeS2;沸腾炉;
(2)反应②的实验是铝热反应,还需用到的药品是镁条、氯酸钾,故答案为:镁条;氯酸钾;
(3)反应④是电解饱和食盐水,化学方程式为:2NaCl+2H2O
 Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;由于生成的Cl2与H2相遇容易发生爆炸,且Cl2与NaOH溶液反应会导致氢氧化钠不纯,电解饱和食盐水使用阳离子交换膜阻止上述情况的发生,
故答案为:2NaCl+2H2O
 Cl2↑+H2↑+2NaOH;防止生成的Cl2与H2相遇容易发生爆炸,避免Cl2与NaOH溶液反应会导致氢氧化钠不纯;
Cl2↑+H2↑+2NaOH;防止生成的Cl2与H2相遇容易发生爆炸,避免Cl2与NaOH溶液反应会导致氢氧化钠不纯;(4)Cl2与NaOH溶液反应生成的NaClO具有强氧化性,将Fe2+氧化为Fe3+,从而生成Fe(OH)3沉淀,ClO-被还原为Cl-,再根据电荷守恒、电子转移守恒、原子守恒配平得:3ClO-+6Fe2++3H2O=2Fe(OH)3+4Fe3++3Cl-,
故答案为:3ClO-+6Fe2++3H2O=2Fe(OH)3+4Fe3++3Cl-.
点评:本题考查了无机物推断,主要涉及中学常见工业生产,综合性较强,(4)中离子方程式的书写为易错点、难点,注意利用守恒进行判断并配平.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
 已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去.
已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去. E(g)
E(g)
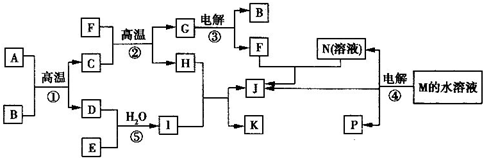 已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去.
已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去.