题目内容
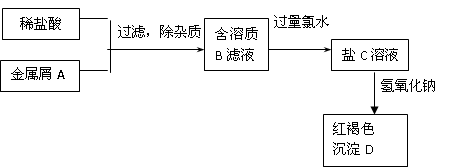
如图表示某种盐C的制备及其性质的实验步骤:
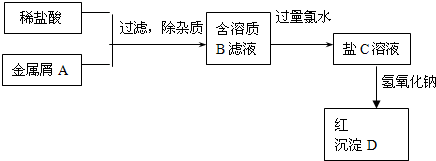
已知:盐C溶液呈黄色;沉淀D焙烧分解,生成红棕色粉末E.
(1)请写出下列物质的化学式:A
(2)写出相应反应的离子方程式A→B
(3)向B的溶液中滴加NaOH溶液,可观察到白色沉淀产生,该沉淀在空气中放置的现象为

已知:盐C溶液呈黄色;沉淀D焙烧分解,生成红棕色粉末E.
(1)请写出下列物质的化学式:A
Fe
Fe
,BFeCl2
FeCl2
,CFeCl3
FeCl3
,DFe(OH)3
Fe(OH)3
,(2)写出相应反应的离子方程式A→B
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
:,B→C:2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
,(3)向B的溶液中滴加NaOH溶液,可观察到白色沉淀产生,该沉淀在空气中放置的现象为
白色沉淀转化为灰绿色,最后变成红褐色
白色沉淀转化为灰绿色,最后变成红褐色
,发生上述变化的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.分析:盐C溶液呈黄色,说明含有铁离子;沉淀D焙烧分解,生成红棕色粉末E,且D为红褐色,则D是Fe(OH)3,E为Fe2O3,根据反应过程中元素守恒知,金属单质A是Fe,铁和盐酸反应生成氯化亚铁和氢气,所以B是FeCl2,氯气具有强氧化性,亚铁离子具有还原性,氯气能将氯化亚铁氧化生成氯化铁,则C是FeCl3,结合物质的性质分析解答.
解答:解:盐C溶液呈黄色,说明含有铁离子;沉淀D焙烧分解,生成红棕色粉末E,且D为红褐色,则D是Fe(OH)3,E为Fe2O3,根据反应过程中元素守恒知,金属单质A是Fe,铁和盐酸反应生成氯化亚铁和氢气,所以B是FeCl2,氯气具有强氧化性,亚铁离子具有还原性,氯气能将氯化亚铁氧化生成氯化铁,则C是FeCl3,
(1)通过以上分析知,A、B、C、D分别是Fe、FeCl2、FeCl3、Fe(OH)3,
故答案为:Fe、FeCl2、FeCl3、Fe(OH)3;
(2)A是铁,B是氯化亚铁,铁和盐酸反应生成氯化亚铁和氢气,离子反应方程式为:Fe+2H+=Fe2++H2↑,氯化亚铁具有还原性,能被氯气氧化生成氯化铁,离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Fe+2H+=Fe2++H2↑;2Fe2++Cl2=2Fe3++2Cl-;
(3)氯化亚铁和氢氧化钠发生复分解反应生成白色的氢氧化亚铁沉淀,氢氧化亚铁不稳定,易被空气中氧气氧化生成红褐色的氢氧化铁沉淀,所以看到的现象是:白色沉淀转化为灰绿色,最后变成红褐色,该反应现象中涉及的反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色沉淀转化为灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(1)通过以上分析知,A、B、C、D分别是Fe、FeCl2、FeCl3、Fe(OH)3,
故答案为:Fe、FeCl2、FeCl3、Fe(OH)3;
(2)A是铁,B是氯化亚铁,铁和盐酸反应生成氯化亚铁和氢气,离子反应方程式为:Fe+2H+=Fe2++H2↑,氯化亚铁具有还原性,能被氯气氧化生成氯化铁,离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Fe+2H+=Fe2++H2↑;2Fe2++Cl2=2Fe3++2Cl-;
(3)氯化亚铁和氢氧化钠发生复分解反应生成白色的氢氧化亚铁沉淀,氢氧化亚铁不稳定,易被空气中氧气氧化生成红褐色的氢氧化铁沉淀,所以看到的现象是:白色沉淀转化为灰绿色,最后变成红褐色,该反应现象中涉及的反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色沉淀转化为灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查了铁及其化合物之间的转化,明确铁及其化合物的性质是解本题关键,注意氢氧化亚铁转化为氢氧化铁的变化现象,难度不大.

练习册系列答案
相关题目