题目内容
反应3Fe(s)+4H2O(g)  Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
 Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )| A.保持体积不变,充入Ne使体系压强增大 | B.将容器的体积缩小一半 |
| C.压强不变,充入Ne使容器的体积增大 | D.保持体积不变,充入水蒸汽 |
A
考查外界条件对反应速率对影响。影响反应速率的因素一般是温度、浓度、压强和催化剂等。A中压强增大,但物质的浓度并没有改变,速率是不变的。B中容器容积缩小,导致气体的浓度增大,反应速率增大。C中容积的增大,导致气体的浓度减小,反应速率降低。D中增大反应物的浓度,反应速率增大。答案选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 ?2B(g)+C(g) ⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是
?2B(g)+C(g) ⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是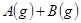

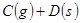 正反应速率加快的是( )
正反应速率加快的是( )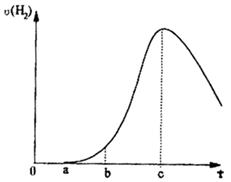
 (OE)、
(OE)、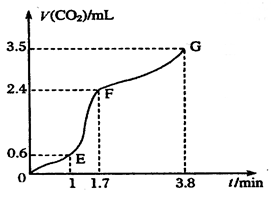
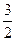 O2(g) ΔH
O2(g) ΔH =+765.2kJ·mol-1
=+765.2kJ·mol-1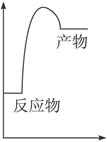
 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为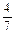 。计算
。计算 。
。