题目内容
【题目】富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可用于制备净水剂明矾KAl(SO4)2·12H2O和补血剂FeSO4·7H2O。工艺流程如下(部分操作和产物略去):
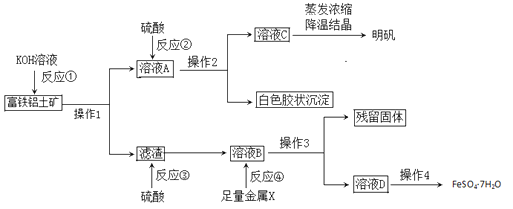
(1)操作1的名称是___________。
(2)反应①②③④中是氧化还原反应的是_______(填写编号)。
(3)综合考虑,金属X最好选择的试剂是__,写出该反应离子方方程式_______。
(4)反应①的离子方程式是_________、__________。
(5)溶液D中含有的金属阳离子是_______,检验方法是________。
(6)用含铝元素27℅的上述矿石10吨,通过上述流程最多生产明矾____吨。
【答案】 过滤 ④ Fe Fe+2Fe3+=3Fe2+ SiO2+2OH-=SiO32-+H2O Al2O3+2OH-=2AlO2-+H2O Fe2+ 取少量溶液D于试管中,滴入硫氰化钾溶液,无现象;再滴入几滴氯水,若变红;证明含有Fe2+ 47.4
【解析】本题考查化学工艺流程,涉及实验基本操作、化学反应类型、离子方程式的书写和化学计算,(1)操作I得到溶液和滤渣,因此操作I为过滤;(2)反应①中加入NaOH溶液,根据成分只有Al2O2和SiO2与NaOH反应,发生Al2O3+2OH-=2AlO2-+H2O,SiO2+OH-=SiO32-+H2O,不属于氧化还原反应,反应②中加入硫酸,发生的SiO32-+2H+=H2SiO3↓,AlO2-+4H+=Al3++2H2O,没有化合价的改变,不属于氧化还原反应,反应③发生Fe2O3+6H+=2Fe3++3H2O,FeO+2H+=Fe2++H2O,没有化合价的改变,不属于氧化还原反应,根据操作4得到FeSO4·7H2O,说明反应④中加入一种金属,把Fe3+转化成Fe2+,即这种金属是铁单质,离子方程式为Fe+2Fe3+=3Fe2+,存在化合价的变化,属于氧化还原反应;(3)操作4得到FeSO4·7H2O,不能引入新杂质,因此此金属为Fe,离子方程式为:Fe+2Fe3+=3Fe2+;(4)根据(1)的分析,离子方程式为Al2O3+2OH-=2AlO2-+H2O,SiO2+OH-=SiO32-+H2O;(5)根据(3)的分析,溶液D中含有的金属阳离子是Fe2+,利用Fe2+的还原性,具体操作是取少量溶液D于试管中,滴入硫氰化钾溶液,无现象;再滴入几滴氯水,若变红;证明含有Fe2+;(6)根据铝元素守恒,明矾的质量有10×106×27%×10-6×474/27t=47.4t。