题目内容
(12分)对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列6种物质:SO2,SiO2,CaO,MgO,Fe2O3,Na2O2按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①___________________________________________________;
②___________________________________________________。
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol/L的FeCl3溶液,可制得一种红褐色胶体。
①反应的化学方程式为_________________________________。
②如何用较简单的方法判断胶体是否制备成功?___________________________________。
(3)若向该胶体中加入饱和(NH4)2SO4溶液,发生的现象是_________________________;
原因是_______________________________________________。
(1)①SO2常温常压下是气体,其余是固体
②Na2O2是过氧化物,其余为酸性氧化物或碱性氧化物(答案不唯一,合理即可)
(2)①FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
②若该分散系能产生丁达尔效应,则制备成功;否则,不成功
(3)形成红褐色沉淀 (NH4)2SO4电离出的SO中和Fe(OH)3胶粒所带的正电荷,使微粒变大,生成沉淀
解析试题分析:(1)6种物质都为氧化物,其中SO2为气体,其它为固态;Na2O2为过氧化物,其余为酸性氧化物或碱性氧化物;答案为:①SO2常温常压下是气体,其余是固体;②Na2O2是过氧化物,其余为酸性氧化物或碱性氧化物;(2)①制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O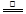 Fe(OH)3(胶体)+3HCl;②溶液不产生丁达尔效应,而氢氧化铁胶体能产生丁达尔效应,答案为:若该分散系能产生丁达尔效应,则制备成功;否则,不成功;(3)(NH4)2SO4电离出的SO42-中和Fe(OH)3胶粒所带的正电荷,使微粒变大,生成红褐色氢氧化铁沉淀;答案为:形成红褐色沉淀;(NH4)2SO4电离出的SO42-中和Fe(OH)3胶粒所带的正电荷,使微粒变大,生成沉淀。
Fe(OH)3(胶体)+3HCl;②溶液不产生丁达尔效应,而氢氧化铁胶体能产生丁达尔效应,答案为:若该分散系能产生丁达尔效应,则制备成功;否则,不成功;(3)(NH4)2SO4电离出的SO42-中和Fe(OH)3胶粒所带的正电荷,使微粒变大,生成红褐色氢氧化铁沉淀;答案为:形成红褐色沉淀;(NH4)2SO4电离出的SO42-中和Fe(OH)3胶粒所带的正电荷,使微粒变大,生成沉淀。
考点:考查物质的分类、胶体的性质,

下图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中不正确的是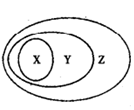
| | X | Y | Z |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 硫酸铜 | 盐 | 纯净物 |
| B | 盐酸 | 电解质溶液 | 分散系 |
| C | 碱性氧化物 | 氧化物 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
下列叙述正确的是
| A.金属氧化物只可能是碱性氧化物或者两性氧化物。 |
| B.鸡蛋清中加入硫酸铜溶液会发生盐析现象。 |
| C.蔗糖、淀粉、油脂及其水解产物均为非电解质。 |
| D.有机分子的结构简式和实验式可能是相同的。 |
下列各项说法或比较中不正确的是
| A.胶体区别于其他分散系的本质特征是丁达尔效应 |
| B.根据电离方程式HCl=H++Clˉ,判断HCl分子里存在离子键 |
| C.氧化性由强到弱顺序:Ag+>Fe3+>Cu2+ |
| D.250C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,化学式为Cu2(OH)2CO3,“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿……→铜”的转化。
(1)从三种不同分类标准回答,“铜绿”属于哪类物质?
________、________、________。
(2)请写出铜绿与盐酸反应的化学方程式_________________________________。
(3)写出B的化学式________。
(4)上述转化过程中属于化合反应的是________,属于复分解反应的是________。
(5)胶体铜在电子行业、塑料和陶瓷电镀等方面应用广泛。下列关于溶液和胶体的叙述,正确的是________。
| A.一束光线分别通过溶液和胶体时,后者能看到一条光亮的“通路”,前者则没有 |
| B.溶液是电中性的,胶体是带电的 |
| C.溶液中溶质分子可以通过滤纸,胶体中分散质粒子则不能通过滤纸 |
| D.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 |
