��Ŀ����
����Ŀ��CuCl�㷺Ӧ���ڻ�����ӡȾ����ҵ��ij�о���ѧϰС�����ȷֽ�CuCl2��2H2O�Ʊ�CuCl������֤�����ֽ���
���������ϡ�
��![]()
��CuCl��һ�ְ�ɫ���ܹ��壬��ʪCuCl�ڿ����л���������
����ƽ��ʪCuCl�ڿ����б������Ļ�ѧ����ʽ_________
____CuCl+_____O2+_____��=_______3CuO��CuCl2��3H2O+______HCl
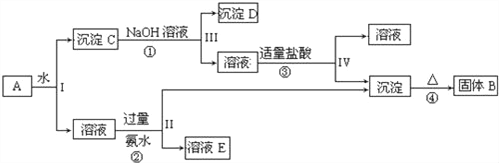
��ʵ��̽������С��ѡ����ͼװ�ý���ʵ�飨�гּ��������ԣ���

��װ��A������ȡHCl��NaCl+H2SO4=NaHSO4+HCl����Ũ�����ڸ÷�Ӧ������ǿ���Ժ�_________�ԣ�
�ǰ�ʵ��Ҫ��ѡ����ͼװ�ã�����˳��Ϊ��a_______��������������Сд��ĸ��ʾ����
�ȸ���������ʵ��װ�ý���ʵ�飬ʵ�鲽�����£�
������װ�ã�_______����װ��ҩƷ���۴�Һ©���������ܿ����¶ȼ���Ӳ�ʲ�����һ��ʱ�䣻��ֹͣͨHCl�����¼������ȣ���
�������__________________�������ͨHCl��Ŀ����_________________��
��װ��E�з�����Ӧ�����ӷ���ʽ��______________________��
��ʵ�������Ľ���
��װ��B����ֽ�ȱ���������ɫ���������ϻ�֪������Cl2�ܽ�I2��������ͬѧ��Ϊ�ɽ�ʪ��ĵ���KI��ֽ�ij������ĵ���KI��Һ�Կ˷�Cl2���������⣬��С���������Ϊ�÷�������һ������ȫ���⣺_____________________
�˷�Ӧ������CuCl��Ʒ�п��ܺ�������δ�ֽ��CuCl2����ͬѧ��Ϊֻ��һ���ճ��������Һ�弴�ɼ��顣��ʵ�鷽��Ϊ��ȡ�����������С�Թ��У�_________________��
���𰸡�4��1��4H2O=1��2�ѻӷ���degfcbh��edgfcbh���װ������������CuCl2ˮ��H+ + OH�C=H2OCl2+2OH�C=Cl�C+ClO�C+H2OHCl������ˮ����������������ˮ���ý����ǽ���Ѹ��������Һ����ɫ���Ʒ�к�CuCl2����������ɫ��CuCl2
��������
����ƽ��ʪCuCl�ڿ����б�������˵����ˮ�μӷ�Ӧ�����������ԭ��Ӧ�ĵ����غ��ԭ���غ㣬�˷�Ӧ�Ļ�ѧ����ʽ����ƽ��Ϊ4CuCl+O2+4H2O=3CuO��CuCl2��3H2O+2HCl��
��ʵ����ͨ������Ũ�����ǿ���Ժ��ѻӷ��Ե����ʣ�ͨ����ӦNaCl+H2SO4=NaHSO4+HCl������ȡHCl��
����Aװ���Ʊ���HClͨ��Cװ�ã�����Dװ����ˮ����ͭ�������ɵ�ˮ��Bװ�ü����Ƿ����������ɣ������Eװ�ý���β����������С������Ⱦ����װ�õ�����˳��Ϊadegfcbh��aedgfcbh��
��װ�����Ӻ�����Ҫ����װ�������ԣ��ٽ��к���ʵ�飻��CuCl2��ˮ��Һ����ˮ�⣬��ͨ��HCl����CuCl2ˮ�⣻
��װ��E����NaOH��Һ���պ���HCl��Cl2��β����������Ӧ�����ӷ���ʽ�� H+ + OH�C=H2O��Cl2+2OH�C=Cl�C+ClO�C+H2O��
�������ʪ��ĵ���KI��ֽ�ij������ĵ���KI��Һ����HCl�������ܽ���ˮ�����ײ������������ڰ�ȫ������
��CuCl2���ܽ���ˮ������ˮ��Һ����ɫ��ͬʱ���ǵ�CuCl�ڳ�ʪ�������������������ʱ���������������ĸ��ţ���������Ǽ�����ˮ���ý����ǽ���Ѹ��������Һ����ɫ���Ʒ�к�CuCl2����������ɫ��CuCl2��

����Ŀ���±�ΪԪ�����ڱ���һ����,��ش��й�����:
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | ||
4 | �� | �� |
��1����������õĽ���Ԫ����____(��дԪ�ط���,����ͬ),�ǽ�������ǿ��Ԫ����_____;
��2������ܵ�����������Ӧˮ����ļ��Խ�������__________����д��ѧʽ����
��3����ҵ��ȡ�ݵĵ��ʵĻ�ѧ��Ӧ����ʽΪ��____________________���ݵ���̬�⻯���ڿ�����ȼ���������������д���÷�Ӧ�Ļ�ѧ����ʽ��______________��
��4��д��һ���ܱȽϢߡ��ⵥ��������ǿ�������ӷ���ʽ:________________��