题目内容
已知Cl-、I-、Fe2+、SO2和H2O2均具有还原性,它们在酸性溶液中还原性顺序为:Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能进行的是( )
A.2Fe3++SO2+2H2O====2Fe2++![]() +4H+ B.I2+SO2+2H2O====2H2SO4+2HI
+4H+ B.I2+SO2+2H2O====2H2SO4+2HI
C.H2O2+H2SO4====SO2↑+O2↑+2H2O D.2Fe2++I2====2Fe3++2I-
CD
解析:
对于一个氧化还原反应,必有氧化性:氧化剂强于氧化产物;还原性:还原剂强于还原产物。反之,如若不然,该反应不能发生。对于A反应,还原剂是SO2,还原产物是Fe2+,则还原性SO2>Fe2+,与已知条件符合,因此A反应能进行;同理,B反应也可以发生;若C反应能进行则推知还原性H2O2>SO2,与已知条件不符,则C不能进行;同理,D反应亦不能进行。

练习册系列答案
相关题目
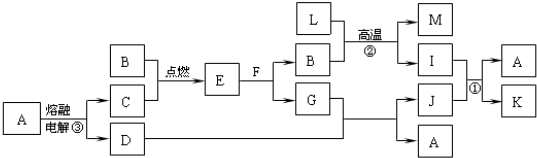





 由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O