题目内容
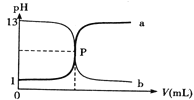
【题目】已知某密闭容器中存在可逆反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g) ΔH。测得其他条件相同时,CO的平衡转化率随着温度(T)、压强(p)的变化如图1中曲线所示, 平衡常数K与温度关系如图2所示。
回答下列问题:
图1  图2
图2 
(1)该反应的ΔH___0(填“>”或“<”,后同),pl____p2,M、N相比,混合气体平均相对分子质量较大的是____。
(2) A、B, C、D四点中能正确表示该反应的平衡常数与温度T的关系的点为_____。
(3)下列各项数据能表明一定温度下,恒容密闭容器中反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)达到平衡状态的是___。
a.气体密度保持不变 b.反应过程中 c(CO):c(H2)=1:2
c.生成速率:v(CO)=2v(H2O) d. ΔH—定
(4)若在恒容条件下,最初向容器中通入1 mol CO、2 mol H2,在适当催化剂、温度下使其发生反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)。测得开始时容器总压为 3xl05Pa,反应经2 min达到平衡且平衡时体系压强降低了![]() ,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
【答案】< > M AC c 2.5×104 2.5×10-21Pa-4
【解析】
(1)由M=![]() 知混合气体总物质的量越小,平均摩尔质量越大,即M点平均摩尔质量较大;
知混合气体总物质的量越小,平均摩尔质量越大,即M点平均摩尔质量较大;
(2)因为温度越高,平衡常数越小;
(3)根据变量不变达平衡进行判断;
(4) 利用三段式进行分析计算。
(1)由图知,其他条件相同时,温度越高CO的平衡转化率越低,说明正反应是放热反应,故△H<0;正反应是气体分子数目减小的反应,故压强越大转化率越大,p1>p2;CO转化率越大,混合气体总物质的量越小,由M=![]() 知平均摩尔质量越大,即M点平均摩尔质量较大;
知平均摩尔质量越大,即M点平均摩尔质量较大;
(2)因为温度越高,平衡常数越小,故符合条件的是A、C (注意从整体上看B、D点均不正确)。
(3)a、由方程式知,气体总质量恒定,容器容积恒定,故密度是个定值,选项a错误;
b、反应过程中a(CO):c(H2)=1:2,取决于反应物充入量,不能判断化学反应是否达到平衡状态,选项b错误;
c、生成2x mol的CO的同时生成x mol的H2O,说明反应达到平衡,选项c正确;
d、对于一个确定的反应方程式来说,△H保持不变,选项d错误。
答案选c;
(4) 2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g)
开始物质的量(mol) 1 2 0 0
变化物质的量(mol) x 2x 0.5x 0.5x
平衡物质的量(mol) 1-x 2-2x 0.5x 0.5x
(1+2):(3-2x)=3×105 : (3×105×![]() ),x=0.5;
),x=0.5;
开始时p(CO)=![]() ×3×105Pa=1×105Pa,
×3×105Pa=1×105Pa,
平衡时p(CO)=![]() ×3×105×
×3×105×![]() Pa=5×104Pa,故v(CO)=2.5×104Pa/min。
Pa=5×104Pa,故v(CO)=2.5×104Pa/min。
p(H2)= 1×105Pa,p(CH3CH2OH)=p(H2O)=![]() ×3×105×
×3×105×![]() Pa =2.5×104Pa,Kp=2.5×10-21Pa-4。
Pa =2.5×104Pa,Kp=2.5×10-21Pa-4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案