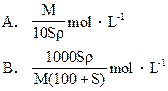题目内容
A、B两种金属元素的相对原子质量之比为8∶9,将A、B两种金属单质按物质的量之比为3∶2组成1.26 g混合物。将此混合物与足量稀硫酸溶液反应,放出1.344 L(标准状况)氢气。若这两种金属单质在反应中生成氢气的体积相等,则A的摩尔质量是? ?,B的摩尔质量是? ?。
24 g·mol-1 27 g·mol-1?
两金属共生成H2的物质的量= ="0.06" mol;两金属生成H2的物质的量相等,各为0.03 mol;A、B物质的量比为3∶2,可推出A为+2价,B为+3价;A为0.03 mol,B为0.02 mol。设相对原子质量的公比为a,则8a×0.03+9a×0.02="1.26" g
="0.06" mol;两金属生成H2的物质的量相等,各为0.03 mol;A、B物质的量比为3∶2,可推出A为+2价,B为+3价;A为0.03 mol,B为0.02 mol。设相对原子质量的公比为a,则8a×0.03+9a×0.02="1.26" g
解得a=3,m(A)="24" g·mol-1,m(B)="27" g·mol-1。
 ="0.06" mol;两金属生成H2的物质的量相等,各为0.03 mol;A、B物质的量比为3∶2,可推出A为+2价,B为+3价;A为0.03 mol,B为0.02 mol。设相对原子质量的公比为a,则8a×0.03+9a×0.02="1.26" g
="0.06" mol;两金属生成H2的物质的量相等,各为0.03 mol;A、B物质的量比为3∶2,可推出A为+2价,B为+3价;A为0.03 mol,B为0.02 mol。设相对原子质量的公比为a,则8a×0.03+9a×0.02="1.26" g解得a=3,m(A)="24" g·mol-1,m(B)="27" g·mol-1。

练习册系列答案
相关题目
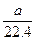 mol·L-1
mol·L-1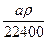 mol·L-1
mol·L-1 mol·L-1
mol·L-1 mol·L-1
mol·L-1