题目内容
【题目】下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是
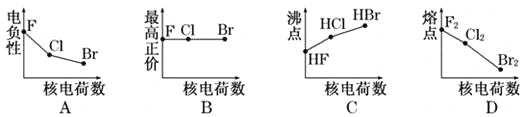
A. A B. B C. C D. D
【答案】A
【解析】试题分析:A.对于卤素来说,随着核电荷数的增大,元素的原子半径逐渐增大,原子获得电子的能力逐渐减小,元素电负性逐渐减小,A正确;B.卤素原子最外层电子数相同,但由于F的非金属性最强,与其他元素形成化合物时,不可能失去电子,因此F没有与族序数相等的最高正化合价,B错误;C.一般情况下,同一主族的元素形成的化合物结构相似,相对分子质量越大,分子之间的作用力就越大,物质的熔沸点就越高。但是在HF的分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的吸引力,使其熔沸点比HBr、HI还高,C错误;D.卤素单质都是由分子构成的物质,相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质的熔化或气化消耗的能量就越高。即物质的熔沸点就越高,D错误。答案选A。

练习册系列答案
相关题目
【题目】下表为元素周期表的一部分:
周期 族 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图_________。
(2)②、③、⑤的离子半径由大到小的顺序为___________。
(3)元素④和⑥形成的化合物的电子式:_____________。
(4)元素②和⑤形成的化合物的化学式为____________。
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
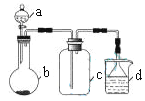
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |

