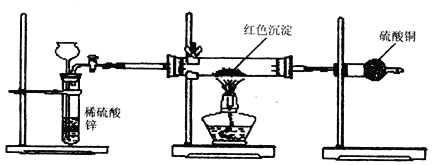
题目内容
【题目】下列微粒在氧化还原反应中只能体现还原性的是
A.NaB.NO2C.Fe2+D.H2SO4
【答案】A
【解析】
在氧化还原反应中只体现还原性,则该物质中的某元素只能升高化合价,即该元素呈最低价态。
A. Na中Na元素呈0价,是Na元素的最低价态,故在化学反应中,Na的化合价只能升高,表现出还原性,A正确;
B. NO2中N呈+4价,是N元素的中间价态,则NO2可以表现出还原性,也可以表现出氧化性,B错误;
C. Fe2+中,Fe呈+2价,是Fe元素的中间价态,则Fe2+既可以表现出还原性,也可以表现出氧化性,C错误;
D. H2SO4中的H呈+1价,S呈+6价,二者都只能表现出氧化性,D错误;
故合理选项为A。

 高中必刷题系列答案
高中必刷题系列答案【题目】现有含FeCl2杂质的CuCl2·2H2O晶体,为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
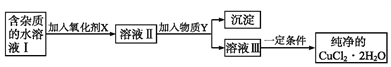
已知:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)得到溶液II,需加入氧化剂X, 加入氧化剂X的目的是____________________________。最适合作氧化剂X的是_________(填编号)。A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入试剂Y,调节溶液的pH范围是__________。下列中不适合作试剂Y的是_______(填编号)。
A.CuO B.Cu(OH)2 C.CuCO3 D.氨水
(3)由溶液Ⅲ得到CuCl2·2H2O晶体的操作是________________________________,过滤,洗涤,干燥。
(4)已知:某难溶物M(OH)3的Ksp=1×10-35 。若要使M3+沉淀完全,溶液的pH最小为______。
【题目】下列离子组在一定条件下能大量共存,且加入相应试剂后所对应的离子方程式正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A |
| 稀硫酸 |
|
B |
| 氢氧化钠溶液 |
|
C |
| 氢氧化钠溶液 |
|
D |
| 过量氢氧化钠溶液 |
|
A. A B. B C. C D. D