题目内容
对溴甲苯是合成农药溴螨酯的重要原料.工业用液溴、甲苯与1-丙醇共热合成对溴甲苯和1-溴丙烷,其原子利用率很高.实验室模拟的合成流程和相关数据如下:
已知:甲苯与溴在有水存在时能反应.


(1)液溴的颜色是______,实验室液溴存放试剂瓶里时应密闭保存,同时需要在瓶中加______,以减少挥发.
(2)25℃恒温搅拌至溴的颜色完全褪去时完成甲苯的溴代反应.搅拌的目的是______.加入水的作用是:易于控制温度;______.
(3)加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,加入浓硫酸的作用是______,加热微沸2小时的目的是______
(4)操作Ⅰ的名称是______洗涤操作应在______(填写仪器名称)中进行.
(5)经以上分离操作后,粗对溴甲苯中还含有的最主要杂质为______(填写名称),使用操作Ⅱ分离出1-溴丙烷的原理是______.
(6)分离出的水溶液中含HBr、H2SO4和Fe3+离子,将水溶液稀释定容至1000mL,取20.00mL,加入几滴甲基橙作指示剂,用一定浓度的NaOH溶液滴定,测定出HBr的物质的量明显低于理论值,原因是______;有同学认为无需加入指示剂,也能完成滴定,提出这一观点的理由是______.
已知:甲苯与溴在有水存在时能反应.

| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | |
| 沸点℃ | 110.8 | 97.2 | 71 | |
| 物质 | 对溴甲苯 | 邻溴甲苯 | ||
| 沸点℃ | 184.3 | 181.7 | ||

(1)液溴的颜色是______,实验室液溴存放试剂瓶里时应密闭保存,同时需要在瓶中加______,以减少挥发.
(2)25℃恒温搅拌至溴的颜色完全褪去时完成甲苯的溴代反应.搅拌的目的是______.加入水的作用是:易于控制温度;______.
(3)加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,加入浓硫酸的作用是______,加热微沸2小时的目的是______
(4)操作Ⅰ的名称是______洗涤操作应在______(填写仪器名称)中进行.
(5)经以上分离操作后,粗对溴甲苯中还含有的最主要杂质为______(填写名称),使用操作Ⅱ分离出1-溴丙烷的原理是______.
(6)分离出的水溶液中含HBr、H2SO4和Fe3+离子,将水溶液稀释定容至1000mL,取20.00mL,加入几滴甲基橙作指示剂,用一定浓度的NaOH溶液滴定,测定出HBr的物质的量明显低于理论值,原因是______;有同学认为无需加入指示剂,也能完成滴定,提出这一观点的理由是______.
(1)液溴为深红棕色液体,易挥发,为减少挥发,可用水封的方法保存,故答案为:深红棕色;水;
(2)反应生成溴化氢,溴化氢易溶于水,水可起到吸收溴化氢的作用,为保证充分接触而反应,应不断搅拌,
故答案为:使互不相溶的液体充分混合;吸收反应生成的溴化氢气体;
(3)浓硫酸起到催化剂的作用,为提高氢溴酸和1-丙醇的利用(转化)率,加热微沸2小时,使之充分反应,
故答案为:催化剂;提高氢溴酸和1-丙醇的利用(转化)率;
(4)将水溶液与互不相溶的有机物分离,可用分液漏斗进行分液操作,得到分离的目的,
故答案为:分液;分液漏斗;
(5)粗对溴甲苯中还含有的最主要杂质为邻溴甲苯,可利用物质的沸点差异,用加热冷凝(蒸馏或分馏)的方法分离,
故答案为:邻溴甲苯;利用物质的沸点差异,用加热冷凝(蒸馏或分馏)的方法分离;
(6)测定出HBr的物质的量明显低于理论值,可能原因为溴(溴化氢)挥发没有参加反应(溴与铁反应生成溴化铁),滴定终点时,有Fe(OH)3红褐色沉淀生成,可以指示滴定终点,所以无需加入指示剂,也能完成滴定,
故答案为:溴(溴化氢)挥发没有参加反应(溴与铁反应生成溴化铁);滴定终点时,有Fe(OH)3红褐色沉淀生成,可以指示滴定终点.
(2)反应生成溴化氢,溴化氢易溶于水,水可起到吸收溴化氢的作用,为保证充分接触而反应,应不断搅拌,
故答案为:使互不相溶的液体充分混合;吸收反应生成的溴化氢气体;
(3)浓硫酸起到催化剂的作用,为提高氢溴酸和1-丙醇的利用(转化)率,加热微沸2小时,使之充分反应,
故答案为:催化剂;提高氢溴酸和1-丙醇的利用(转化)率;
(4)将水溶液与互不相溶的有机物分离,可用分液漏斗进行分液操作,得到分离的目的,
故答案为:分液;分液漏斗;
(5)粗对溴甲苯中还含有的最主要杂质为邻溴甲苯,可利用物质的沸点差异,用加热冷凝(蒸馏或分馏)的方法分离,
故答案为:邻溴甲苯;利用物质的沸点差异,用加热冷凝(蒸馏或分馏)的方法分离;
(6)测定出HBr的物质的量明显低于理论值,可能原因为溴(溴化氢)挥发没有参加反应(溴与铁反应生成溴化铁),滴定终点时,有Fe(OH)3红褐色沉淀生成,可以指示滴定终点,所以无需加入指示剂,也能完成滴定,
故答案为:溴(溴化氢)挥发没有参加反应(溴与铁反应生成溴化铁);滴定终点时,有Fe(OH)3红褐色沉淀生成,可以指示滴定终点.

练习册系列答案
相关题目






 ,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件)______:
,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件)______: 广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.
广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.
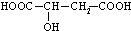 ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )