题目内容
在标准状况下氢气和一氧化碳的混和气体7L,质量为2.25g,求H2和CO质量分数和体积分数.
分析:利用
=
求出混合气体的平均摩尔质量,根据十字交叉法计算各组分的物质的量之比,由此计算其质量分数和体积分数.
. |
| M |
| m |
| n |
解答:解:混合气体的平均摩尔质量为
=
=
=7.2g/mol,
利用十字交叉法计算各组分的物质的量之比:
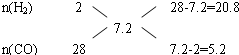
即
=
=
H2的质量分数量分数为ω(H2)=
×100%=22.2%;
CO的质量分数量分数为ω(CO)=1-ω(H2)=1-22.2%=77.8%;
体积之比等于物质的量之比,所以:
H2的体积分数为φ(H2)=
=
;
CO的体积分数为φ(CO)=1-φ(H2)=1-
=
.
答:质量分数:H2 22.2%,CO 77.8%,体积分数:H2 80%,CO 20%.
. |
| M |
| m |
| n |
| 2.25g | ||
|
利用十字交叉法计算各组分的物质的量之比:
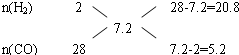
即
| n(H2) |
| n(CO) |
| 20.8 |
| 5.2 |
| 4 |
| 1 |
H2的质量分数量分数为ω(H2)=
| 4mol×2g/mol |
| 4mol×2g/mol+1mol×28g/mol |
CO的质量分数量分数为ω(CO)=1-ω(H2)=1-22.2%=77.8%;
体积之比等于物质的量之比,所以:
H2的体积分数为φ(H2)=
| 4mol |
| 4mol+1mol |
| 4 |
| 5 |
CO的体积分数为φ(CO)=1-φ(H2)=1-
| 4 |
| 5 |
| 1 |
| 5 |
答:质量分数:H2 22.2%,CO 77.8%,体积分数:H2 80%,CO 20%.
点评:本题考查了物质的量的有关计算,难度不大,注意十字交叉法是解题的一种简便方法,有事半功倍之效.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
 在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是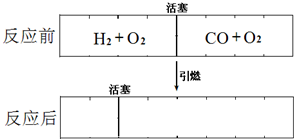 在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是________或________.(液态水的体积忽略不计)
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是________或________.(液态水的体积忽略不计)
