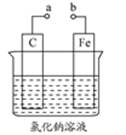
题目内容
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月。其电池反应为:2CH3OH+3O2+4OH- 2CO32—+6H2O,则下列说法正确的是( )
2CO32—+6H2O,则下列说法正确的是( )
 2CO32—+6H2O,则下列说法正确的是( )
2CO32—+6H2O,则下列说法正确的是( )| A.放电时CH3OH参与反应的电极为正极 |
| B.放电时负极的电极反应为CH3OH+8OH--6e-=CO32—+6H2O |
| C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移 |
| D.放电一段时间后,通入氧气的电极附近溶液的pH降低 |
B
A项,放电时为原电池装置,失去电子一极为负极,得到电子一极为正极,CH3OH中碳元素化合价升高,失电子,参与反应的电极为负极;C项,标准状况下,通入5.6 L O2即0.25 mol完全反应后,转移电子数为4×0.25 mol=1 mol;D项,放电时通入氧气一端方程式为:O2+2H2O+4e-=4OH-,电极附近c(OH-)增加,pH增大。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目