题目内容
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,其相关热化学方程式为如图所示,下列说法正确的是( )
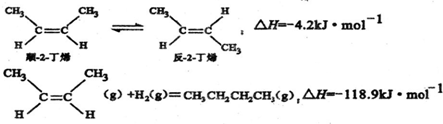

| A、顺-2-丁烯比反-2-丁烯稳定 | B、顺-2-丁烯的燃烧热数值比反-2-丁烯大 | C、顺-2-丁烯和反-2-丁烯分别与氢气加成后所得产物不同 | D、反-2-丁烯氢化的热化学方程式为: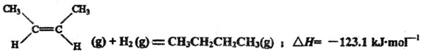 |
分析:A.能量越低越稳定;
B.若生成物相同,反应物的能量高,则放出的热量多;
C.氢气加成后无顺反异构;
D.盖斯定律指若一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.
B.若生成物相同,反应物的能量高,则放出的热量多;
C.氢气加成后无顺反异构;
D.盖斯定律指若一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.
解答:解:A.顺-2-丁烯转化为反-2-丁烯放热,说明反-2-丁烯能量低,更稳定,故A错误;
B.等量的顺-2-丁烯具有更高的能量.所以顺-2-丁烯燃烧热更大,故B正确;
C.顺、反2-丁烯的与氢气加成后变为烷烃,不存在顺反异构,故C错误;
D.将下式-上式相加得到反-2-丁烯氢化的热化学方程式,△H=-118.9kJ?mol-1-(-4.2kJ?mol-1)=-114.7kJ?mol-1,故D错误.
故选B.
B.等量的顺-2-丁烯具有更高的能量.所以顺-2-丁烯燃烧热更大,故B正确;
C.顺、反2-丁烯的与氢气加成后变为烷烃,不存在顺反异构,故C错误;
D.将下式-上式相加得到反-2-丁烯氢化的热化学方程式,△H=-118.9kJ?mol-1-(-4.2kJ?mol-1)=-114.7kJ?mol-1,故D错误.
故选B.
点评:本题考查能量越低越稳定和盖斯定律、影响平衡的因素等,难度适中,注意掌握运用盖斯定律解题.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡, △H=-4.2kJ/mol
△H=-4.2kJ/mol
 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ/mol;
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ/mol;
下列说法正确的是( )
 △H=-4.2kJ/mol
△H=-4.2kJ/mol (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ/mol;
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ/mol;下列说法正确的是( )
| A、顺-2-丁烯比反-2-丁烯稳定 | B、顺-2-丁烯的燃烧热比反-2-丁烯大 | C、加压和降温有利于平衡向生成顺-2-丁烯反应方向移动 | D、反-2-丁烯氢化的热化学方程式为 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-114.7kJ/mol (g)+H2(g)→CH3CH2CH2CH3(g)△H=-114.7kJ/mol |

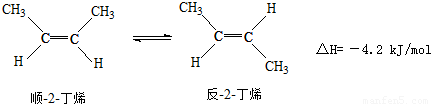
 +H2(g)→CH3CH2CH2CH3(g),△H=-118.9 kJ?mol-1
+H2(g)→CH3CH2CH2CH3(g),△H=-118.9 kJ?mol-1