题目内容
某一定量的锌与稀硫酸反应,收集到4.48L氢气(标准状况)。计算:
(1)标准状况下4.48L氢气的物质的量;
(2)参加反应的锌的质量;
(3)若所用稀硫酸的浓度为0.4 mol/L,则至少需要硫酸溶液的体积为多少升?
(1)0.2mol (2)13g (3)0.5L
解析试题分析:解:(1)标准状况下4.48L氢气的物质的量为 =0.2mol,
=0.2mol,
令参加反应的Zn的物质的量为xmol,则:
Zn+H2SO4=ZnSO4+H2↑
1 1
xmol 0.2mol
故x=0.2,
故参加反应的Zn的质量为0.2mol×65g/mol=13g,
答:参加反应的Zn的质量为13g;
(2)令参加反应的硫酸的物质的量为ymol,则:
Zn+H2SO4=ZnSO4+H2↑
1 1
ymol 0.2mol
故y=0.2,
至少需要硫酸溶液的体积为0.5L,
考点:化学方程式的有关计算

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列溶液中溶质的物质的量浓度为1mol/L的是( )
| A.将40 g NaOH溶解在1L水中 |
| B.将1 L 10mol/L的浓盐酸加入9 L水中 |
| C.将22.4 L HCl气体溶于水配成1 L溶液 |
| D.将10g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
将标准状况下的 LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
A. mo1·L-1 mo1·L-1 | B. mol·L-1 mol·L-1 | C. mol·L-1 mol·L-1 | D. mol·L-1 mol·L-1 |
下列溶液中的C1-的物质的量浓度与150.0mL l.0 mol/L CaCl2溶液中的Cl-物质的量浓度相等的是
| A.150 .0mL 1 .0 mol/L NaCl溶液 | B.75 .0mL 2.0 mol/L MgCl2溶液 |
| C.150 .0mL 2 .0 mol/LKCl溶液 | D.75.0 mL 1 .0 mol/L A1C13溶液 |
某氯原子的质量为a g,12C原子的质量为b g。用NA表示阿伏加德罗常数,下列说法中不正确的是
A.ng该氯原子所含的电子数为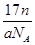 |
B.mg该氯原子的物质的量为 mol mol |
C.该氯原子的相对原子质量为 |
| D.0.5 mol该氯分子的质量为aNAg |
NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,NA个分子所占的体积约为22.4 L |
| B.标准状况下,2.24L CH4和NH3混合气体中含有的电子数目为NA |
| C.0.1 mol·L-1的K2SO4溶液中阴、阳离子总数为0.3NA |
| D.标准状况下,22.4L氢气和氦气混合气体中含有的原子总数为2NA |
有一定体积CH4、C2H6、C3H8组成的混合气体,是同温同压下H2密度的15倍。则混合气体中CH4、C2H6、C3H8的体积比不可能是:
| A.2∶1∶2 | B.2∶3∶1 | C.1∶4∶1 | D.5∶3∶5 |
下列溶液中的氯离子数目与50 mL 1 mol·L-1的AlCl3溶液中氯离子数目相等的是( )
| A.150 mL 1 mol·L-1的NaCl | B.75 mL 1 mol·L-1的FeCl3 |
| C.150 mL 3 mol·L-1的KCl | D.75 mL 2 mol·L-1的CaCl2 |