题目内容
(9分)(1)A图是课本中“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:
H2+CuO![]() Cu+H3O所属的区域。
Cu+H3O所属的区域。

(2)“四种基本反应类型与氧化还原反应的关系”也可用B图表达。其中I为化合反应,则Ⅱ为 反应。写出有水生成的符合反应类型III的一个化学方程式: 。写出有水参加的符合反应类型IV的一个化学方程式: ,其中水为 剂。
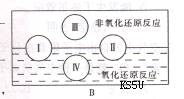
(1)
(2)分解;NaOH+Hcl==NaCI+H20;C+ H20![]() C0+H2;氧化(其他合理答案也可)(各2分)
C0+H2;氧化(其他合理答案也可)(各2分)

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案(9分) (1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度。
①100°C时1mol·L﹣1的NaOH溶液中,由水电离出的c(H+)= mol·L﹣1,KW(25°C)
KW(100°C)
(填“>”、“<”或“=”)。
②25°C时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是 (填“促进”“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
④25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,混合后所得溶液显碱性,则c(Na+) c(CH3COO-)(填“>”、“<”或“=”)。
⑤向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
。
(15分)(1)右图是![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 过程中能量变化示意,请写出
过程中能量变化示意,请写出![]() 和
和![]() 反应的热化学方程式_________________________________。
反应的热化学方程式_________________________________。
(2)已知下列热化学方程式:
![]()
![]() =-393.5 kJ?mol-1
=-393.5 kJ?mol-1
![]()
![]() =-483.6 kJ?mol-1
=-483.6 kJ?mol-1
![]()
![]() =-283.0 kJ?mol-1
=-283.0 kJ?mol-1
由此可知反应:![]() 9
9![]() 的焓变为_________。
的焓变为_________。
 (3)某温度时
(3)某温度时![]() 在水中的沉淀溶解平衡曲线如同所示。(提示
在水中的沉淀溶解平衡曲线如同所示。(提示![]() ⇋
⇋![]() (aq)的平衡秆数
(aq)的平衡秆数![]() ?
?![]() ,称为溶度积常数。)下列说法正确的是_____(填字母序号)。
,称为溶度积常数。)下列说法正确的是_____(填字母序号)。
A.加入![]() 可以使溶液由a点变到b点
可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无![]() 沉淀生成
沉淀生成
D.a点对应的![]() 等于c点对应的
等于c点对应的![]()
(4)在一固定体积的密闭容器中,进行如下化学反应:
![]()
![]() <0,其化学平衡常数K与t关系如下表:
<0,其化学平衡常数K与t关系如下表:
t/K | 298 | 398 | 498 | …… |
K/(mol?L | 4.1× | K | K | …… |
请完成下列问题:
①试比较K![]() 、K
、K![]() 的大小,K1_______K2(填写“>”“=”或“<”)
的大小,K1_______K2(填写“>”“=”或“<”)
②下列各项能作为判断浚反应达到化学平衡状态的依据的是__________(填字母序号)。
A.容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2 B.
的浓度之比为1:3:2 B. ![]()
C.容器内坼强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改蛮 E.混合气体中各成分的浓度不再改变

