题目内容
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(表中的“实验方案”与“实验现象”前后不一定是对应关系)
请你帮助该同学整理并完成实验报告
(1)实验目的:______
(2)实验用品:仪器:①砂纸②______③______④______⑤试管夹、试管架⑥滤纸⑦镊子⑧小刀⑨玻璃片⑩锥形瓶(100mL)等;
药品:钠、镁条、铝条、2mol/L的盐酸、AlCl3溶液、氢氧化钠溶液等.
(3)实验内容:(填写与实验方案相对应的实验现象和有关离子方程式)
(4)实验结论:______.
| 实验方案 | 实验现象 |
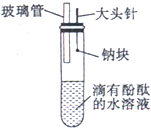
| ①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
| ②钠与滴有酚酞试液的冷水反应 | B.有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色 |
| ③镁带与2mol/L的盐酸反应 | C.反应不十分剧烈,产生的气体可以在空气中燃烧 |
| ④铝条与2mol/L的盐酸反应 | D.生成白色胶状沉淀,继而沉淀消失 |
| ⑤向氯化铝溶液中滴加氢氧化钠溶液至过量 | E.剧烈反应,产生的气体可以在空气中燃烧 |
(1)实验目的:______
(2)实验用品:仪器:①砂纸②______③______④______⑤试管夹、试管架⑥滤纸⑦镊子⑧小刀⑨玻璃片⑩锥形瓶(100mL)等;
药品:钠、镁条、铝条、2mol/L的盐酸、AlCl3溶液、氢氧化钠溶液等.
(3)实验内容:(填写与实验方案相对应的实验现象和有关离子方程式)
| 实验方案 | 实验现象 (填写字母) |
有关离子方程式 |
| ① | ______ | Mg+2H2O(热水)═Mg(OH)2+H2↑ |
| ② | ______ | ______ |
| ③ | ______ | Mg+2H+═Mg2++H2↑ |
| ④ | ______ | ______ |
| ⑤ | ______ | 补全离子方程式 Al3++3OH-=______ Al(OH)3+OH-=______ |
(1)根据题意“某同学做同周期元素性质递变规律实验时”以及所做实验可以判断,本实验的实验目的是:验证第三周期金属元素的金属性的递变规律.
故答案为:验证第三周期金属元素的金属性的递变规律;
(2)②做钠与滴有酚酞试液的冷水反应,一般应在烧杯中进行,③做镁带与2mol/L的盐酸反应,一般要在试管中进行,④做铝条与2mol/L的盐酸反应,一般要在试管中反应,
故答案为:②烧杯 ③试管 ④试管;
(3)①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞,其现象应是:有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色,即B.②钠与滴有酚酞试液的冷水反应,
反应方程式是2Na+H2O═2NaOH+H2↑,其离子方程式是2Na+H2O═2Na-+2OH-+H2↑,其现象应该是:浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色,即A.③镁
带与2mol/L的盐酸反应,其现象应是:剧烈反应,产生的气体可以在空气中燃烧,即E.值得注意的是镁比铝活泼,因此与盐酸反应,镁比铝剧烈.④铝条与2mol/L的盐酸反应,其
化学方程式是2Al+6HCl═2AlCl3+3H2↑,即离子方程式是2Al+6H+═2Al3++3H2↑,其现象是:反应不十分剧烈,产生的气体可以在空气中燃烧,即C.⑤向氯化铝溶液中滴加氢氧化
钠溶液至过量,其现象:生成氢氧化铝白色胶状沉淀,继而在氢氧化钠过量时氢氧化铝与氢氧化钠反应使沉淀消失,即D.本实验发生反应的离子方程式是:Al3++3OH-═Al(OH)3↓,
Al(OH)3+OH-═AlO2-+2H2O.故答案为:①B; ②A;2Na+H2O═2Na-+2OH-+H2↑;③E;④C;2Al+6H+═2Al3++3H2↑;⑤D;Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O;
(4)根据实验①②,说明与水反应时钠比镁剧烈,即钠的金属性比镁强.根据③④,说明与同浓度的盐酸反应,铝比镁剧烈,即铝的金属性比镁强.⑤说明氢氧化铝既能与酸反应,又能与碱反应,即氢氧化铝既有酸性又有碱性,因此铝既有金属性又有非金属性.由以上分析第三周期,金属元素的金属性由强到弱的顺序是:Na>Mg>Al,即同周期从左到右元素的金属性逐渐减弱.故答案为;同周期从左到右元素的金属性逐渐减弱.
故答案为:验证第三周期金属元素的金属性的递变规律;
(2)②做钠与滴有酚酞试液的冷水反应,一般应在烧杯中进行,③做镁带与2mol/L的盐酸反应,一般要在试管中进行,④做铝条与2mol/L的盐酸反应,一般要在试管中反应,
故答案为:②烧杯 ③试管 ④试管;
(3)①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞,其现象应是:有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色,即B.②钠与滴有酚酞试液的冷水反应,
反应方程式是2Na+H2O═2NaOH+H2↑,其离子方程式是2Na+H2O═2Na-+2OH-+H2↑,其现象应该是:浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色,即A.③镁
带与2mol/L的盐酸反应,其现象应是:剧烈反应,产生的气体可以在空气中燃烧,即E.值得注意的是镁比铝活泼,因此与盐酸反应,镁比铝剧烈.④铝条与2mol/L的盐酸反应,其
化学方程式是2Al+6HCl═2AlCl3+3H2↑,即离子方程式是2Al+6H+═2Al3++3H2↑,其现象是:反应不十分剧烈,产生的气体可以在空气中燃烧,即C.⑤向氯化铝溶液中滴加氢氧化
钠溶液至过量,其现象:生成氢氧化铝白色胶状沉淀,继而在氢氧化钠过量时氢氧化铝与氢氧化钠反应使沉淀消失,即D.本实验发生反应的离子方程式是:Al3++3OH-═Al(OH)3↓,
Al(OH)3+OH-═AlO2-+2H2O.故答案为:①B; ②A;2Na+H2O═2Na-+2OH-+H2↑;③E;④C;2Al+6H+═2Al3++3H2↑;⑤D;Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O;
(4)根据实验①②,说明与水反应时钠比镁剧烈,即钠的金属性比镁强.根据③④,说明与同浓度的盐酸反应,铝比镁剧烈,即铝的金属性比镁强.⑤说明氢氧化铝既能与酸反应,又能与碱反应,即氢氧化铝既有酸性又有碱性,因此铝既有金属性又有非金属性.由以上分析第三周期,金属元素的金属性由强到弱的顺序是:Na>Mg>Al,即同周期从左到右元素的金属性逐渐减弱.故答案为;同周期从左到右元素的金属性逐渐减弱.

练习册系列答案
相关题目
 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.