题目内容
【题目】无论是鲜重还是干重,组成细胞的元素中C、H、O、N这四种元素的含量最多,其中一种在干重中的含量达到55.99%,这表明构成细胞最基本的元素是
A. C B. H C. O D. N
【答案】A
【解析】
C、H、O、N元素占鲜重的比例从大到小的顺序是:O>C>H>N;C、H、O、N元素占干重的比例从大到小的顺序是:C>O>N>H。
干重中含量最多的元素是C元素,说明构成细胞最基本的元素是C,A正确。

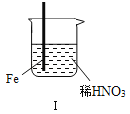
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
(1)真空碳热还原一氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJmol﹣1
3AlCl(g)═2Al(l)+AlC13(g)△H=b kJmol﹣1
用含a、b的代数式表示反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=_____kJmol﹣1.
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=Q kJmol﹣1.在T1℃时,反应进行到不同时间测得各物质的浓度如下(时间单位为min,浓度单位为mol/L):
| 0 | 10 | 20 | 30 |
NO | 1.00 | 0.68 | 0.50 | 0.50 |
N2 | 0 | 0.16 | 0.25 | 0.25 |
CO2 | 0 | 0.16 | 0.25 | 0.25 |
①0~10min内,NO的平均反应速率v(NO)=_____,T1℃时,该反应的平衡常数K=_____.
②30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q_____0(填“>”、“<”或“═”)
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是_____ (填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol/L,则反应平衡时c(NO)=_____mol/L.NO的转化率_____(填“增大”、“减小”或“不变”).
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题,将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.电极b表面发生的电极反应式为_____.