��Ŀ����
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
��1����CO2�뽹̿��������CO��CO�����������ȡ�
����֪��Fe2O3(s) + 3C(ʯī) = 2Fe(s) + 3CO(g) ��H 1 = +489.0 kJ��mol��1
C(ʯī) +CO2(g) = 2CO(g) ��H 2 = +173.0 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ ��
��ij��C��H��O����Ԫ�ص��л���A�����ⶨ̼����������Ϊ52.16%�������������13.14%����������ȼ�ϵ�أ���KOH��ҺΪ���Һ����ԭ�ϣ�д���õ�صĸ�����Ӧʽ ��
��2��ijʵ�齫CO2��H2����һ��������ܱ������У�������Ӧ��
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) ��H =��49.0 kJ��mol��1
CH3OH(g) +H2O(g) ��H =��49.0 kJ��mol��1
�ش����⣺
���÷�Ӧ��ƽ�ⳣ������ʽΪ ��
����0.5mol��CO2��1.5mol��H2����2L���ܱ������У�����Ӻ���c��H2��=0.15mol/L,��CH3OH��ʾ�÷�Ӧ�����ʣ�v(CH3OH)=
����ͼ���ڷ�Ӧ��ϵ�м����������Ӧ��������,E2�ı仯�� �������������� ����С��������������

��1����Fe2O3(s) +3 CO(g)= 2Fe(s) +3CO2(g) ��H = -30 kJ��mol��1��2�֣�
��C2H5OH ��12e- + 16OH- = 2CO32- + 11H2O��2�֣�
��2����K=[c(CH3OH) ?c(H2O)]/ [c(CO2) ?c3(H2)] ��1�֣�
��0.4 mol/(L?min) ��1�֣�
�ۼ�С��1�֣�
��������
�����������1�����ݸ�˹���ɣ��ѷ���ʽ��2������Ȼ�����3���ͷ���ʽ��1����ӣ��ɵ�Fe2O3(s) +3 CO(g)= 2Fe(s) +3CO2(g) ��H = -173��3+489= -30 kJ��mol��1 ����n(C)=52.16/12=4.34��n(H)=13.14��n(O)=(100-52.16-13.14)/16=2.17��4.34:13.14:2.17=2:6:1������ȷ��ȼ��Ϊ�Ҵ����Ҵ���������ʧ���ӷ���������Ӧ���ڼ��������²���Ϊ̼�����C2H5OH ��12e- + 16OH- = 2CO32- + 11H2O
��2��v(H2)=(0.75-0.15)/0.5=1.2mol/L����������֮�ȵ��ڷ���ʽϵ�����ɵü״�������Ϊ������1/3����0.4 mol/(L?min)��������������Խ��ͻ�ܣ�E1��E2����С��
���㣺�����ȷ��̵���д����˹���ɡ�ԭ��ء���ѧ��Ӧԭ��

�ĸ������ͬ���ܱ���������һ���������·�����Ӧ�� 2SO2+O2  2SO3����Ӧ��ʼʱ����Ӧ�����ɴ�С����˳����ȷ����
2SO3����Ӧ��ʼʱ����Ӧ�����ɴ�С����˳����ȷ����
���� | �¶� | SO2(mol) | O2(mol) | ���� |
�� | 500�� | 10 | 5 | - |
�� | 500�� | 10 | 5 | V2O5 |
�� | 450�� | 8 | 5 | - |
�� | 500�� | 8 | 5 | - |
A���ң��ף������� B���ң��ף������� C���ף���=������ D���ң��ף���=��
ʵ��������������ˮ���������Ҵ��Ʊ�1,2�����������װ������ͼ��ʾ��
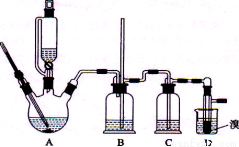
�й������б����£�
| �Ҵ� | 1,2-�������� | ���� |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶȣ�g �� cm-3 | 0.79 | 2.2 | 0.71 |
�е㣯�� | 78.5 | 132 | 34.6 |
�۵㣯�� | -l30 | 9 | -1l6 |
�ش��������⣺
��1�� ��ƿA�з�������Ҫ�ķ�Ӧ����ʽ�� ��
��2�� ��ȫƿB���Է�����,�����Լ��ʵ�����ʱ�Թ�D�Ƿ�����������д����������ʱƿB�е����� ��
��3�� ��װ��C��Ӧ���� (����ĸ) ����Ŀ����
a��ˮ b��Ũ���� c������������Һ
��4����������������δ��Ӧ��Br2������� ϴ�ӳ�ȥ��(����ĸ)
a��ˮ b������������Һ c���⻯����Һ d���Ҵ�
��5�������������������������ѣ����� �ķ�����ȥ��
��6����Ӧ������Ӧ����ˮ��ȴװ��D�����ֲ��ܹ�����ȴ(���ñ�ˮ)����ԭ���� ��

