题目内容
11.现有100mL CuSO4溶液,它的密度是1.10g•cm-3,其中Cu2+的质量分数是6.4%,则下列有关该溶液的说法中不正确的是( )| A. | 溶质的质量分数是25% | |
| B. | 溶质的物质的量浓度是1.10 mol•L-1 | |
| C. | 溶质和溶剂的物质的量之比是1:50 | |
| D. | 硫酸根离子的质量分数是9.60% |
分析 A、根据溶液的体积和密度计算溶液质量,根据铜离子的质量分数计算溶质的质量,溶质的质量分数等于溶质质量和溶液质量的比值;
B、根据溶质物质的量浓度等于溶质物质的量和溶液体积的比值来计算;
C、的体积和密度计算溶液质量,根据铜离子的质量分数计算溶质的质量,进而计算溶剂质量,得到溶质和溶剂的物质的量之比;
D、根据硫酸铜质量结合铜离子质量分数计算硫酸根离子的质量,进而计算硫酸根离子的质量分数.
解答 解:A、100mL CuSO4溶液,它的密度是1.10g•cm-3,溶液质量是110g,其中Cu2+的质量分数是6.4%,所以硫酸铜的质量是$\frac{160×110×6.4%}{64}$=17.6g,
溶质的质量分数是$\frac{17.6g}{110g}$×100%=16%,故A错误;
B、硫酸铜的质量是$\frac{160×110×6.4%}{64}$=17.6g,物质的量浓度=$\frac{\frac{17.6g}{160g/mol}}{0.1L}$=1.10mol•L-1,故B正确;
C、100mL CuSO4溶液,它的密度是1.10g•cm-3,溶液质量是110g,硫酸铜的质量是$\frac{160×110×6.4%}{64}$=17.6g,水的质量是110g-17.6g=92.4g,溶质和溶剂的物质的量之比是$\frac{17.6g}{160g/mol}$:$\frac{92.4g}{18g/mol}$=0.11:5.13≈1:50,故C正确;
D、硫酸铜的质量是$\frac{160×110×6.4%}{64}$=17.6g,硫酸根离子的质量是10.56g,溶液质量是110g,硫酸根离子的质量分数是=$\frac{10.56g}{110g}$×100%=9.60%,故D正确.
故选A.
点评 本题涉及溶液中溶质的质量分数以及溶质的物质的量浓度的计算等方面的知识,难度不大.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案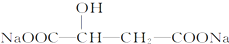 )可作为调味剂、缓冲剂、保水剂以及防腐保鲜剂,广泛应用于饮料、肉制品、口服液等.有关说法错误是( )
)可作为调味剂、缓冲剂、保水剂以及防腐保鲜剂,广泛应用于饮料、肉制品、口服液等.有关说法错误是( )| A. | 苹果酸的酸性强于醋酸 | |
| B. | 分别对苹果酸、苹果酸钠溶液微热,溶液的pH均增大 | |
| C. | 苹果酸在一定条件下发生消去反应可生成HOOCCH═CHCOOH | |
| D. | 苹果酸在一定条件下发生取代反应可生成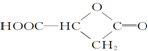 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 0.1 mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 使石蕊试液变红的溶液:Ca2+、Na+、ClO-、NO3- |
| A. | 碳酸钙与足量盐酸反应 CO32-+2H+═CO2↑+H2O | |
| B. | 铜与足量FeCl3溶液反应 Fe3++Cu═Fe2++Cu2+ | |
| C. | 钠与足量稀硫酸反应 2Na+2H+═2Na++H2↑ | |
| D. | 钠与足量MgCl2溶液反应 2Na+Mg2+═2Na++Mg |
| A. | 氢气和氦气 | B. | 一氧化碳和氮气 | C. | 二氧化碳和氨气 | D. | 甲烷和氨气 |
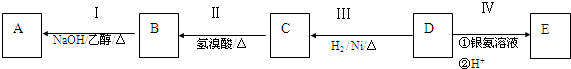
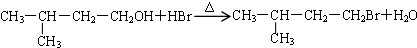 ;
; ;
; .
.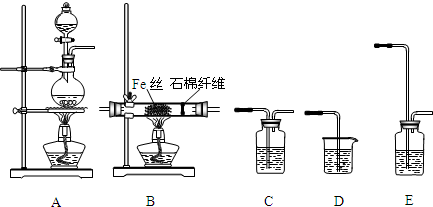
 去年5月12日四川汶川发生特大地震后为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.
去年5月12日四川汶川发生特大地震后为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.