题目内容
【题目】为探究氯气的性质,某兴趣小姐设计如下实验:
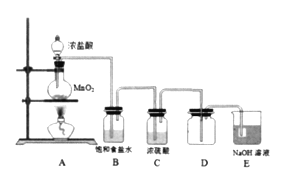
(1)装置B中饱和食盐水的作用是_________。
(2)点燃A处酒精灯,一段时间后,取出装置D,将烧红的铁丝伸入D中,可以观察到_________。
(3)有同学提出可用饱和Na2SO3溶液代替NaOH溶液吸收多余的氯气,其原因是________________(用离子方程式表示)。
【答案】 吸收HCl气体,降低Cl2在水中的溶解度 铁丝剧烈燃烧,产生棕黄色的烟 SO32-+ Cl2 + H2O = SO42-+ 2H++2C1-
【解析】二氧化锰与浓盐酸在加热时反应生成氯气,生成的氯气中含有氯化氢和水蒸气,因此需要除杂,氯气有毒,需要防止污染空气。
(1)装置B中饱和食盐水是用来吸收HCl气体,降低Cl2在水中的溶解度,故答案为:吸收HCl气体,降低Cl2在水中的溶解度;
(2)点燃A处酒精灯,一段时间后,烧瓶中充满氯气,取出装置D,将烧红的铁丝伸入D中,可以观察到铁在氯气中燃烧,产生棕黄色的烟,故答案为:铁丝剧烈燃烧,产生棕黄色的烟;
(3)氯气具有氧化性,能够与饱和Na2SO3溶液发生氧化还原反应,SO32-+ Cl2 + H2O = SO42-+ 2H++2C1-,故答案为:SO32-+ Cl2 + H2O = SO42-+ 2H++2C1-。

【题目】乙二醇(沸点:197.3℃)是一种重要的的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制备得到草酸二甲酯(沸点:164.5℃),再加氢间接合成乙二醇,具有反应条件温和、环境污染小等优点。反应过程如下:
反应 I:4NO(g)+ 4CH3OH (g)+ O2 (g)![]() 4CH3ONO(g)+ 2H2O(g) △H1=a kJ·mol-1
4CH3ONO(g)+ 2H2O(g) △H1=a kJ·mol-1
反应 II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=bkJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=bkJ·mol-1
反应III:CH3OOCCOOCH3 (1)+ 4H2(g)![]() HOCH2CH2OH(1)+ 2CH3OH (g) △H3=ckJ·mol-1
HOCH2CH2OH(1)+ 2CH3OH (g) △H3=ckJ·mol-1
(1)煤基合成气间接合成乙二醇的总热化学方程式是_________,在较低温条件下,该反应能自发进行的可能原因是_________。
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2L的密闭容器中发生反应II,达到平衡时NO的体积分数33.3%,若此时向容器中通入0.4molNO,一段时间后,重新达到新平衡时NO的体积分数_________33.3% (填“>”、“=”、“<”)。
(3)温度改变对反应II的催化剂活性有影响,评价催化剂活性参数:空时收率和CO选择性,表示式如下:
空时收率=![]()
CO的选择性=![]() ×100%
×100%
在不同温度下,某兴趣小组对四组其他条件都相同的反应物进行研究,经过相同时间t小时,测得空时收率、CO选择性数据如下表所示。
反应温度(℃) | 空时收率(g· mL-1· h-1) | CO的选择性(% ) |
130 | 0.70 | ① 72.5 |
140 | 0.75 | ② 71.0 |
150 | 0.71 | ③ 55.6 |
160 | 0.66 | ④ 63.3 |
下列说法正确的是_________。
A.温度升高,空时收率先增大后减少,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO的选择性逐渐降低,所以数据④肯定错误
C.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
D.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
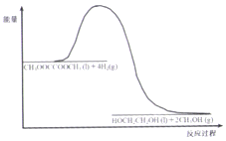
(4)120℃、常压时,CH3OOCCOOCH3+4H2![]() HOCH2CH2OH +2CH3OH 反应过程中能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中能量变化图。_______
HOCH2CH2OH +2CH3OH 反应过程中能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中能量变化图。_______
(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是_________。